Abstract
L’influenza che la dieta esercita sul microbiota intestinale rappresenta un’area di ricerca emergente con un impatto significativo sulla salute umana. Tuttavia gli effetti della carne bovina, la tipologia di carne rossa più consumata negli Stati Uniti, sul profilo microbico intestinale non sono ben studiati. Seguendo i Preferred Reporting Items for Systematic Review and Meta-Analysis Protocols, l’obiettivo di questa review sistematica era quello di condurre una review precisa e approfondita dell’attuale letteratura scientifica sugli effetti delle proteine della carne bovina (e sulla conseguente bioattività delle proteine e degli amminoacidi contenuti in questa tipologia carne) sul microbiota intestinale, allo scopo di individuare le lacune presenti in letteratura e di orientare le priorità della ricerca futura. Utilizzando i database MEDLINE Complete, PubMed, ScienceDirect, Scopus e Google Scholar, sono stati ricercati i seguenti termini e le loro combinazioni combinazioni: proteine animali, aminoacidi, carne bovina, composti bioattivi, dieta, salute, microbioma, peptide, carne bovina trasformata e proteine. Per svolgere questo studio sono stati identificati 131 articoli, dei quali 15 sono stati inclusi in questa review. Gli effetti della carne bovina sui topi e sui ratti erano per lo più concordanti per quanto riguardava il livello del phylum batterico. Un consumo a breve termine (1-4 settimane) di carne bovina ha avuto un effetto minimo o nullo sui profili microbici negli esseri umani. La maggior parte degli studi utilizzava un consumo di carne bovina elevato (240-380 g/giorno) e nessuno studio esaminava le quantità raccomandate di proteine [∼ 3.71 oz/giorno (105 g/giorno) proteine di carne, pollame e uova, o ∼26 once/settimana (737 g/wk) provenienti sempre da queste fonti alimentari] dalle linee guida dietetiche statunitensi. Inoltre, la maggior parte degli studi su animali ed umani che mostrava risultati negativi esaminava l’impatto della carne bovina nel contesto di una dieta ricca di grassi o zuccheri. In conclusione, esiste un ampio divario nella letteratura riguardo la carne bovina e il microbiota intestinale. Sono necessari ulteriori studi per chiarire il ruolo del microbiota in seguito al consumo di carne bovina, soprattutto in rapporto con altre componenti della dieta, e per valutare come la preparazione, la lavorazione e i metodi di cottura della carne possano influenzare in maniera differente gli effetti biologici della carne bovina sulla salute umana.
Introduzione
Gli Stati Uniti sono una nazione leader nel consumo di carne rossa, con stime del 2017 che indicano 49.5 kg (109 libbre) pro capite, che dovrebbero aumentare a 50.8 kg (112 libbre) entro il 2027 (1). Una recente valutazione NHANES delle tendenze nel consumo di carne dal 1999 al 2016 ha riportato che la carne bovina rappresenta la tipologia di carne rossa più consumata negli Stati Uniti (2). Date le crescenti preoccupazioni per la salute legate al consumo di carne rossa (3), è fondamentale capire come le funzioni biologiche dei nutrienti presenti in questa tipologia di carne, specialmente in quella bovina, possano variare ed incidere in modo diverso sulla salute, dato che il profilo nutrizionale della carne varia a seconda della tipologia consumata (per esempio, carne bianca o rossa, carne lavorata o non lavorata) (vedere la Tabella 1 per la terminologia definita) (4). Le proteine possiedono proprietà nutrizionali, funzionali e biologiche e svolgono un ruolo essenziale nella salute umana. Una valutazione completa della qualità delle proteine alimentari include la composizione degli amminoacidi, la digeribilità, la velocità di digestione delle proteine e la capacità di generare composti biologicamente attivi (cioè peptidi bioattivi) (5). Al momento del consumo, le proteine di origine animale forniscono tutti i 9 amminoacidi essenziali richiesti dal corpo umano. La carne rossa è anche una fonte di ferro eme, che ha una maggiore biodisponibilità (cioè, significa che è più assorbibile) rispetto al ferro non eme presente nelle piante (6), oltre che di vitamine (in particolare vitamine del gruppo B) e di minerali, come rame, manganese, zinco e ferro (7). Inoltre, ricerche più recenti suggeriscono che le fonti proteiche alimentari (quelle animali rispetto a quelle vegetali) e i loro nutrienti associati possono influenzare in maniera differente il microbiota intestinale (8-10), che viene riconosciuto come un importante mediatore tra cibo e ospite (11) capace di promuovere o prevenire lo sviluppo di malattie croniche e metaboliche, inclusi il cancro e le malattie cardiovascolari (12, 13). Il tratto intestinale umano ospita 10 trilioni di microrganismi, inclusi batteri, virus, funghi e protozoi. Il profilo batterico intestinale di questi microrganismi, noto come “microbiota intestinale”, è di notevole interesse, dato il ruolo che gioca nello sviluppo di malattie nell’uomo (14, 15). Le modificazioni del microbiota – o gli specifici cambiamenti in particolari microbi o gruppi di microbi – alterano l’omeostasi intestinale. La disbiosi intestinale è caratterizzata da cambiamenti negativi del profilo microbico (16), che favoriscono l’aumento dell’infiammazione sistemica tramite il passaggio di sostanze proinfiammatorie provenienti dall’intestino (come i LPS batterici). L’infiammazione contribuisce ulteriormente all’aumento del rischio di sviluppo di malattie metaboliche e croniche, come obesità, diabete e cancro (14, 17). Nel tratto digerente umano sono presenti 5 principali phyla batterici, inclusi Firmicutes, Bacteroidetes, Actinobacteria, Proteobacteria e Verrucomicrobia. Firmicutes (Gram positivi) e Bacteroidetes (Gram negativi) rappresentano la maggioranza, andando a formare il 65% circa dei batteri totali (18). I microrganismi che risiedono nell’intestino umano variano da individuo a individuo in base a diversi fattori, tra cui modalità di nascita, sesso, età, salute, peso corporeo, dieta, attività fisica e storico dell’utilizzo di farmaci, in particolare di antibiotici (19). I cambiamenti nella dieta alterano rapidamente la microflora del colon, sottolineando come essa possa influire fortemente sul microbiota, anche più della genetica dell’ospite (20, 21). Poiché questi batteri sono i principali responsabili della scomposizione degli amidi indigeribili, diversi studi pubblicati si sono concentrati sulla risposta del microbiota ai carboidrati alimentari (22, 23). Inoltre, gli studi condotti sull’uomo si concentravano anche sulla risposta del microbiota alla quantità e alla qualità dei grassi assunti con dieta (24, 25). Tuttavia, sappiamo molte meno cose per quanto riguarda la risposta del microbiota alla digestione delle proteine.
Proteine e microbiota
I batteri del colon possiedono un notevole potere proteolitico. L’attività metabolica della comunità microbica intestinale è forse più efficace anche di quella che si verifica nell’intestino tenue sotto il controllo enzimatico dell’ospite (26, 27). Nel tratto gastroenterico, le proteine vengono prima idrolizzate dalle peptidasi a polipeptidi e successivamente a sequenze di amminoacidi: tripeptidi, dipeptidi e singoli amminoacidi. Le proteasi batteriche possono generare piccoli peptidi e singoli amminoacidi che possono essere fermentati per produrre SCFA, inclusi acetato, propionato e n-butirrato, nonché derivati di aminoacidi a catena ramificata, acidi grassi a catena ramificata, che includono isobutirrato, isovalerato e 2-metilbutirrato (28, 29). Gli amminoacidi Arg, Asp, Gly, Phe, Pro, Ser, Thr e Trp vanno maggiormente incontro a digestione batterica piuttosto che a digestione da parte dell’ospite (30). Sebbene la digestione e l’assorbimento delle proteine alimentari siano efficienti negli esseri umani sani, circa il 10% di esse raggiunge intatta l’intestino crasso ed è disponibile per la fermentazione batterica (31, 32). Le prime tecniche di microbiologia basate su colture fecali umane hanno identificato Bacteroides e Propionibacterium come i due principali generi proteolitici (28). Altri generi importanti proposti sono Bifidobacterium, Clostridium e Streptococcus (28, 33). Molti fattori possono influenzare la percentuale di proteine alimentari che raggiungono l’intestino crasso e che qui vengono digerite dai batteri. Tuttavia, le modificazioni cui vanno incontro le proteine durante la cottura, così come le interazioni che possono avere con altri nutrienti presenti negli alimenti, possono alterare la loro biodisponibilità (34). Inoltre, gli enzimi microbici utilizzano siti di scissione diversi da quelli degli enzimi digestivi e quindi producono peptidi diversi con differente attività biologica (35). È interessante notare come studi recenti affermino che la presenza di batteri nel tratto digestivo umano possa mediare la produzione di composti tossici derivanti dalle proteine, come la produzione di trimetilammina dalla L-carnitina attraverso il metabolismo microbico (36). Pertanto le interazioni tra microflora del colon e proteine alimentari hanno suscitato un forte interesse per quanto riguarda i loro effetti sulla salute umana, poiché il profilo microbico è influenzato dalla dieta e l’attività degli enzimi microbici influisce sulla produzione di peptidi bioattivi derivati dalle proteine.
TABELLA 1 – Termini più rilevanti correlati alla carne bovina.
Proteine della dieta provenienti dalla carne bovina
I composti bioattivi derivati dalle proteine sono generalmente peptidi a basso peso molecolare (<5 kDa), e possono essere o prodotti intermedi della proteolisi (degradazione delle proteine) o sequenze di amminoacidi all’interno della proteina che, se isolati, esercitano un effetto benefico sulla funzionalità corporea con conseguenti potenziali effetti benefici sulla salute umana (al di là di qualsiasi valore nutrizionale conosciuto) (37). Esistono 3 modi in cui possono essere generati i peptidi bioattivi: 1) durante la digestione tramite gli enzimi digestivi; 2) durante la digestione tramite gli enzimi microbici; e 3) durante la lavorazione o la maturazione degli alimenti in seguito all’impiego di enzimi purificati o microbici (38, 39). Sia il sito di digestione coinvolto che l’enzima responsabile possono produrre peptidi differenti, alterando così la bioattività (35). I processi che portano alla formazione di peptidi, unitamente alle limitazioni e alle opportunità presenti in questi processi, sono stati sottoposti ad una approfondita review (40). Sebbene il fabbisogno proteico sia ben stabilito – la RDA per le proteine è di 0.8 g/kg di peso corporeo/giorno, con un’assunzione ≤ 2.5 g/kg di peso corporeo/giorno ritenuta accettabile (41) – non esistono valori consigliati dalla legge o dai medici per i composti bioattivi derivati dalle proteine, ed abbiamo poche informazioni riguardanti i loro fabbisogni e i corrispettivi benefici per la salute. I peptidi derivati dalle proteine hanno varie proprietà bioattive, comprese proprietà antipertensive, funzione di leganti per i minerali, proprietà antimicrobiche, immunomodulatrici, modulanti le cellule, antitumorali, antinfiammatorie e ipocolesterolemizzanti (40, 42-45). È stato ampiamente studiato e stabilito il ruolo dei peptidi biologicamente attivi provenienti da fonti proteiche alimentari, come il latte (46), il pesce (47), le alghe (43) e la soia (48) sulla salute umana; tuttavia, il ruolo dei composti bioattivi provenienti da alimenti ricchi di proteine, compresa la carne bovina, è molto meno noto. I peptidi bioattivi e gli amminoacidi provenienti dal muscolo (carne) includono anserina (β-Ala-1-metil-His), carnosina (β-Ala-His), L-carnitina (β-idrossi-γ-acido trimetilamminobutirrico), glutatione (γ-Glu-Cys-Gly) e taurina (49–51). Di questi, i dipeptidi contenenti istidina, carnosina (β-Ala-His) e anserina (β-Ala-1-metil-His), sono i principali dipeptidi presenti nel muscolo scheletrico dei mammiferi (49). Esiste un numero limitato di studi sulla presenza di amminoacidi e peptidi nella carne bovina e spesso contengono informazioni incomplete e risultati discordanti. Soltanto uno studio sulla carne bovina (52) ha cercato di determinare tutti gli amminoacidi (proteinogenici e non proteinogenici) e il contenuto di piccoli peptidi presenti in questa tipologia di carne ed ha riportato che la glutammina è l’amminoacido più abbondante, seguito da taurina, alanina, glutammato e β-alanina (52). La degradazione post-mortem delle proteine porta alla produzione di frammenti di polipeptidi, che possono essere ulteriormente idrolizzati tramite peptidil peptidasi e aminopeptidasi per generare peptidi più piccoli e singoli amminoacidi (53). Le concentrazioni di questi dipeptidi bioattivi sono più basse nella carne di manzo cotta rispetto a quelle che si ritrovano nel muscolo fresco (54, 55); tuttavia, la carne di manzo cotta rimane ancora una fonte considerevole di carnosina e anserina (55). È di fondamentale importanza capire come rispondano i singoli ceppi del microbiota intestinale, nonché come interagiscano tra di loro come gruppi funzionali, quando vengono esposti a carboidrati, grassi e proteine e come, a loro volta, questi cambiamenti influenzino la produzione dei loro prodotti enzimatici. Pertanto, attraverso questa review sistematica, i ricercatori hanno svolto una revisione rigorosa d approfondita dell’attuale letteratura scientifica che si occupa degli effetti del consumo di carne bovina sul microbiota intestinale; la carne bovina è stata scelta perché è la carne rossa maggiormente consumata negli Stati Uniti. É stata esaminata la bioattività delle proteine della carne bovina e degli amminoacidi sul microbiota intestinale ed identificato le lacune presenti in letteratura per orientare le future priorità di ricerca.
Metodi
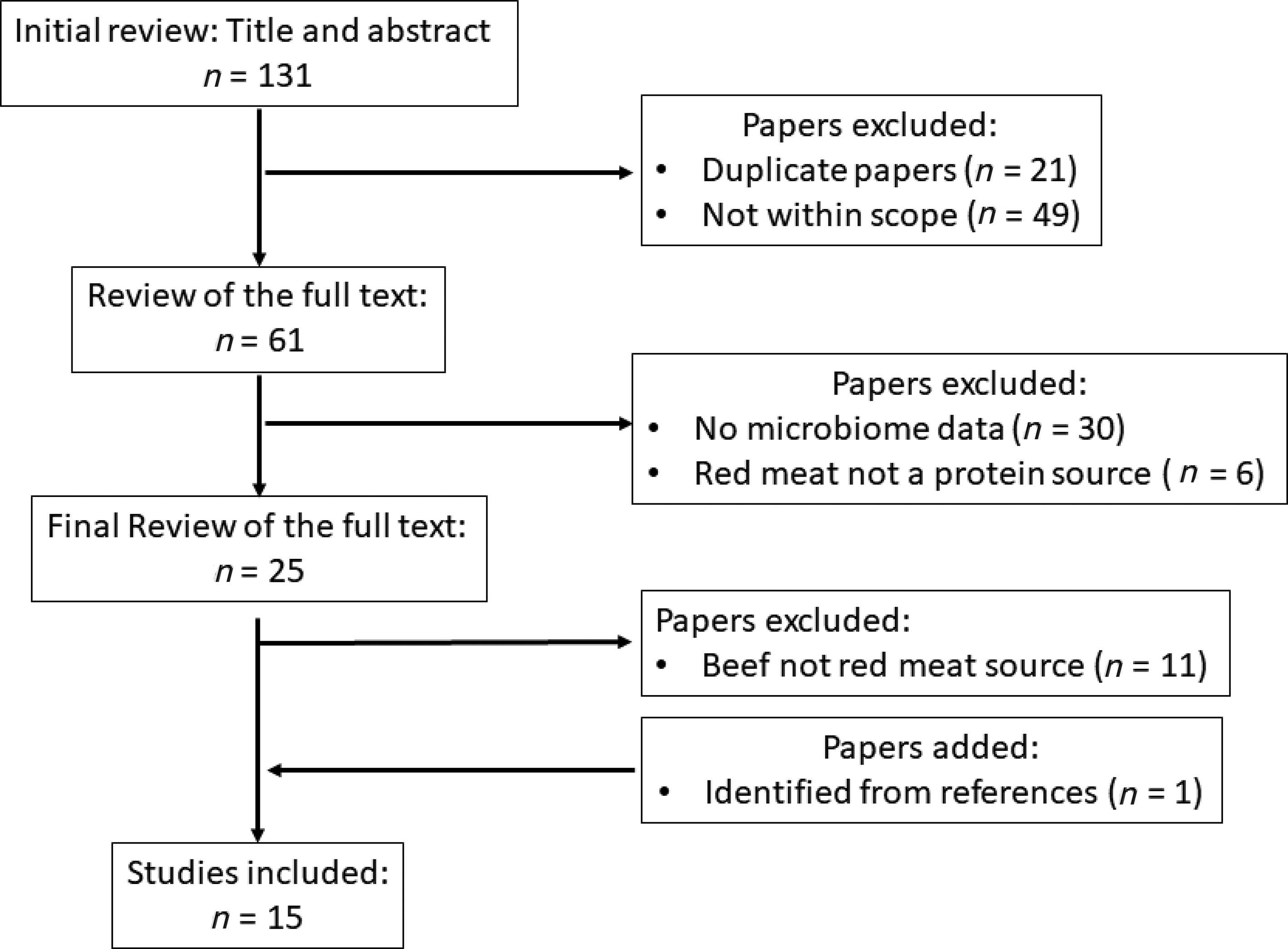
Questa review sistematica ha fatto riferimento e seguito le checklist (Tabella supplementare 1) fornite dai Preferred Reporting Items for Systematic Review and Meta-Analysis Protocols (PRISMA-P) (56). La ricerca in letteratura ha individuato gli studi condotti sugli animali e sull’uomo pubblicati dalla creazione del database fino al 31 luglio 2019. Abbiamo raccolto articoli peer-reviewed e scritti in inglese provenienti da: 1) MEDLINE Complete, 2) PubMed, 3) ScienceDirect, 4) Scopus e 5) Google Scholar. I termini di ricerca includevano combinazioni delle seguenti parole: proteina animale, aminoacidi, carne bovina, bioattivi, dieta, salute, microbioma, peptidi, carne bovina lavorata e proteine. Sono stati recuperati e riesaminati gli articoli pertinenti e, a partire da quelli, abbiamo analizzato attentamente i riferimenti per individuare eventuali articoli mancati. Gli articoli contenenti il descrittore “carne rossa”, dove veniva specificato che la carne rossa era rappresentata da carne bovina come fonte proteica primaria, sono stati inclusi in questa review sistematica (Figura 1). Sono stati esclusi gli articoli che non includevano la carne bovina come tipologia di alimento. Tre revisori indipendenti hanno determinato l’idoneità dell’articolo.
Risultati
Nel complesso, è stato trovato un numero esiguo di studi che esaminavano il ruolo giocato dalle proteine della carne bovina sul microbiota. Sulla base dei criteri selezionati, questo studio ha individuato un totale di 15 articoli ritenuti idonei ed ha incluso 10 studi condotti sugli animali e 5 sull’uomo.
FIGURA 1 – Diagramma di flusso PRISMA che rappresenta la descrizione del processo di selezione della letteratura da inserire nella review sistematica. PRISMA, Preferred Reporting Items for Systematic Reviews and Meta-Analyses.
Proteina della carne bovina e microbiota intestinale: studi sugli animali
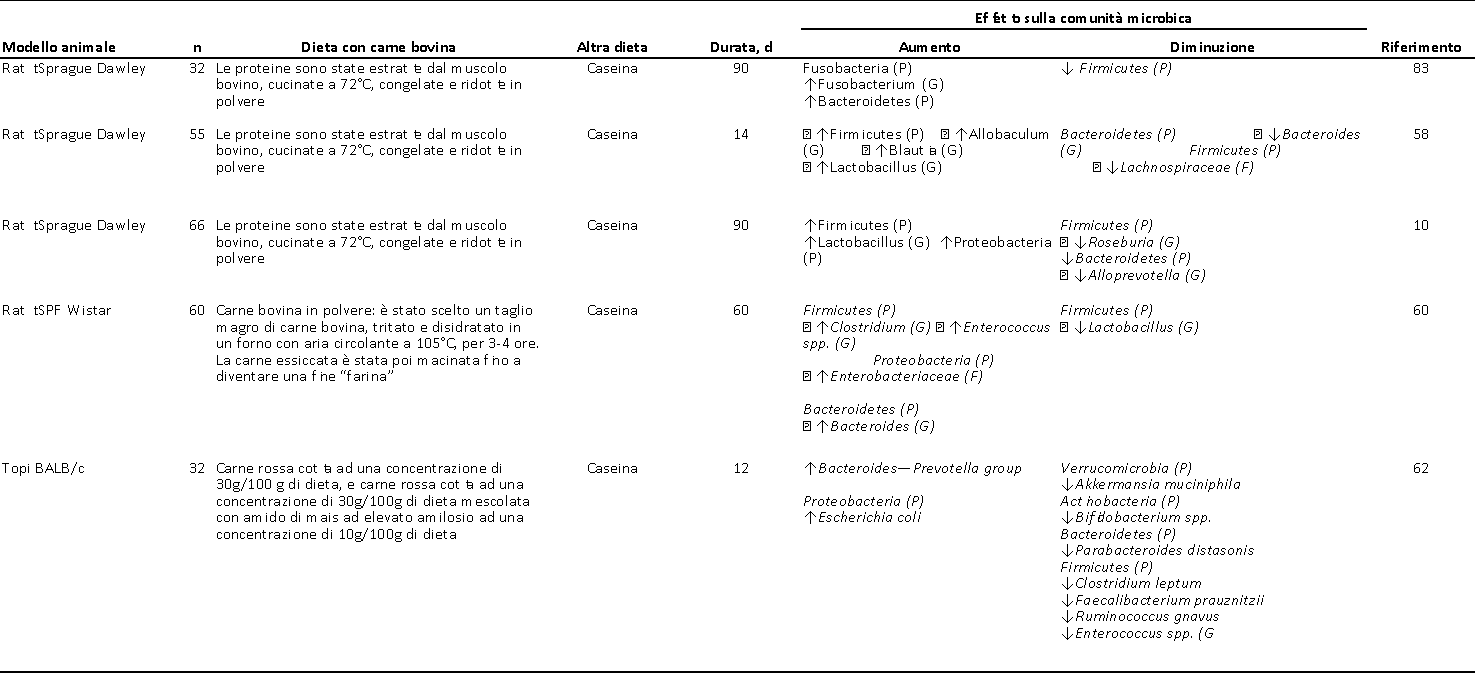
Gli effetti della carne bovina sui modelli di topo e di ratto apparivano concordanti per quanto riguarda il livello di phylum batterico (Tabella 2), con aumenti nella quantità relativa di Proteobacteria (10, 57) e Firmicutes (10, 57, 58) e diminuzioni di Bacteroidetes (10, 57). Il genere capace di produrre acido lattico, Lactobacillus, aumentava quando veniva somministrato come alimento soltanto l’estratto di carne bovina (10, 58). La nostra ricerca in letteratura ha indicato anche che la somministrazione di carne bovina faceva aumentare i Proteobacteria, sia nei modelli murini che suini (59). Vedere la Tabella 3 per i risultati degli studi condotti sui suini. Il consumo di carne bovina ha avuto un effetto misto su alcuni dei generi batterici produttori di SCFA. Ad esempio, la carne bovina ha fatto aumentare la presenza dei generi Clostridium (57, 60) e Blautia (58, 61), mentre sono diminuiti Bifidobacterium (62) e Akkermansia (61, 62). Tutti gli studi condotti su topi e ratti sono stati effettuati sui maschi, ciò sottolinea la necessità di effettuare ulteriori studi su modelli animali femminili.
Proteina della carne bovina e microbiota intestinale: studi sull’uomo
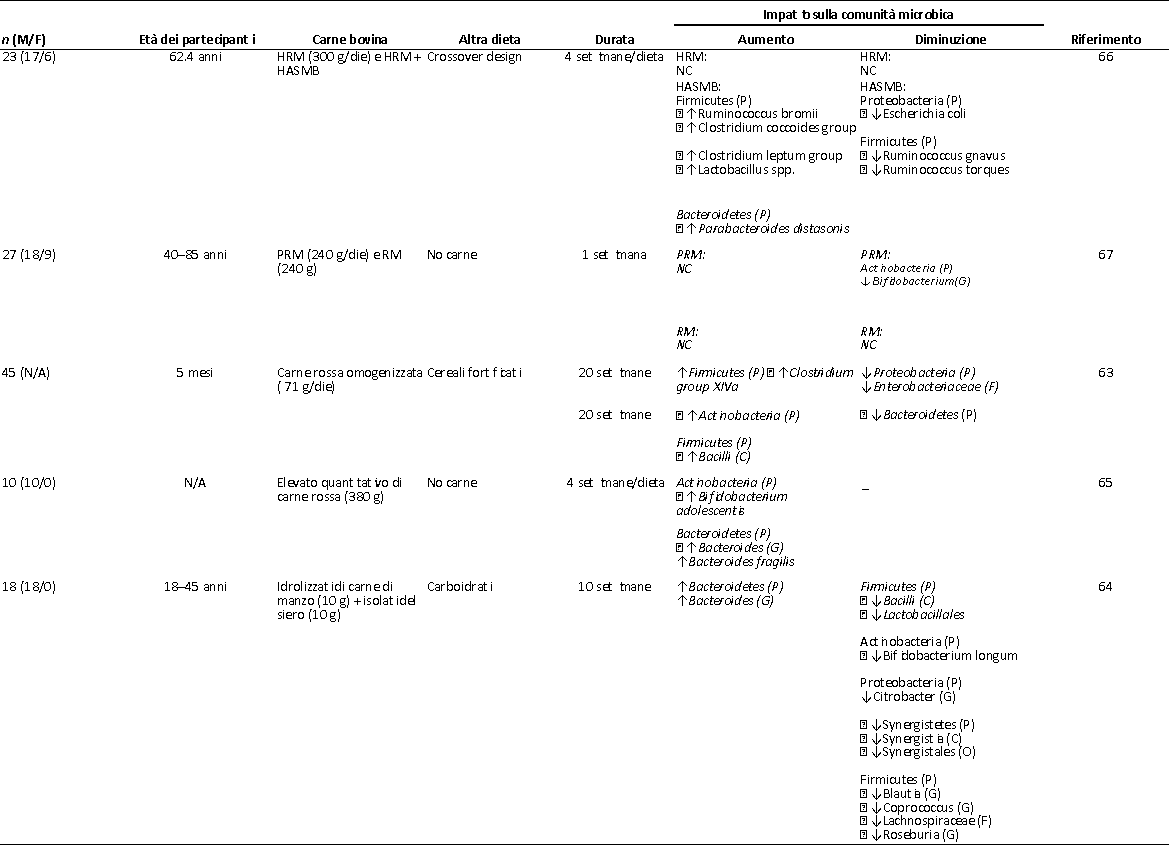
Nei 5 studi condotti sull’uomo e rilevanti per la nostra tematica riguardante le proteine della carne bovina e il microbiota intestinale negli esseri umani, si evidenziava una variazione considerevole dell’influenza che la carne aveva sul microbiota intestinale (Tabella 4); molto probabilmente questa è la risultante di differenze negli obiettivi, nel disegno dello studio, nella durata dell’intervento, nelle caratteristiche del soggetto, nella porzione di carne e nella composizione della dieta. Ad esempio, i soggetti coinvolti andavano dai neonati allattati al seno (63) agli atleti di resistenza (64). Sistematicamente, il consumo di carne bovina a breve termine (1-4 settimane) ha avuto un effetto minimo o nullo sul profilo microbico (65-67). La maggior parte degli studi impiegava una dieta ad elevato contenuto di carne bovina (240-380 g/giorno) (65-67) e nessuno studio prendeva in esame le quantità di proteine raccomandate dalle Dietary Guidelines for Americans (68).
TABELLA 2 – Effetti del consumo di carne bovina sul microbiota di topi e ratti maschi 1
1) C, classe; F, Famiglia; G, Genere; HFB, carne bovina ad elevato contenuto di grassi; LFB, carne bovina a basso contenuto di grassi; O, Ordine; P, Phylum. Le frecce indicano i cambiamenti riportati: ↑, aumento; ↓, diminuzione. I Taxa (Phyla) sono elencati senza frecce per chiarezza. *Cambiamento significativo, P < 0.05. Le frecce senza * indicano cambiamenti basati sulla quantità relativa.
TABELLA 3 – Effetti del consumo di carne bovina sul microbiota dei suini1.
1)G, Genere; P, Phylum. Le frecce indicano i cambiamenti riportati sulla base della quantità relativa: ↑, aumento; ↓, diminuzione. *Cambiamento significativo, P < 0.05. I Taxa (Phylum) sono elencati senza frecce per chiarezza
TABELLA 4 – Effetti del consumo di carne bovina sul microbiota dell’uomo1
1) C, Classe; F, Famiglia; G, Genere; HAMSB, carne rossa molto magra + amido di mais ad elevato contenuto di amilosio butilato; HRM, carne rossa molto magra; NC, nessun cambiamento tra il basale e le successive 4 settimane di HRM; O, Ordine; P, Phylum; PRM, carne rossa lavorata; RM, carne rossa. Le frecce indicano i cambiamenti riportati: ↑, aumento; ↓, diminuzione. I Taxa (Phyla) sono elencati senza frecce per chiarezza. *Cambiamento significativo, P < 0.05. Le frecce senza * indicano cambiamenti basati sulla quantità relativa.
Discussione
La carne è una fonte proteica alimentare completa, contenente tutti gli amminoacidi essenziali, ed è anche una fonte di acidi grassi, vitamine e minerali (69). Inoltre, le proteine animali promuovono la sazietà e migliorano il dispendio energetico e la perdita di grasso rispetto alle proteine vegetali (70). Studi osservazionali hanno segnalato il consumo di carne rossa come un fattore di rischio per le malattie cardiovascolari ed per altre malattie metaboliche, come il diabete mellito di tipo 2, sebbene studi più recenti abbiano indicato che questo legame potrebbe esistere soltanto in caso di consumo di carni rosse trasformate (3). Rispetto ai controversi risultati sulla salute, la maggior parte degli studi inclusi in questa review esaminava l’effetto del consumo eccessivo di carne bovina in concomitanza con una dieta ricca di grassi o zuccheri. Questa tipologia di dieta, a volte identificata come dieta occidentale o dieta Americana standard, viene indipendentemente da tutto associata ad un aumento del rischio di malattie croniche non trasmissibili (71), ed è spesso correlata ad un consumo elevato di cibi raffinati e trasformati (comprese le carni lavorate, gli zuccheri semplici (aggiunti) e i grassi) e ad un basso consumo di frutta, verdura e cereali integrali. Inoltre, una recente indagine clinica ha riportato che gli alimenti ultraprocessati favoriscono l’aumento di peso indipendentemente dall’assunzione energetica (72), evidenziando la necessità di comprendere meglio l’associazione tra il consumo di carne rossa, trasformata e non, e il rischio di sviluppare malattie croniche (73, 74), specialmente per quanto riguarda il ruolo che gioca il microbiota intestinale e i metaboliti correlati, nel mediare gli effetti del consumo di carne magra o delle proteine provenienti dalla carne bovina. Se assunte in concomitanza con una dieta ricca di grassi o zuccheri, le proteine della carne bovina possono influire negativamente sulla salute, sulla composizione del microbiota e sulla barriera intestinale rispetto alla caseina o alle proteine della carne bianca (61, 75), ad esempio, andando ad aumentare il numero di Proteobacteria (75), che sono associati alla disbiosi (76). Tuttavia, i cambiamenti della composizione della flora batterica in risposta a diete con un elevato contenuto di grassi + manzo o con un elevato contenuto di saccarosio + manzo sono paragonabili a quelli riportati negli studi sugli animali per l’alimentazione con la dieta occidentale, con aumenti di Desulfovibrionaceae e diminuzioni di Lactobacillaceae (77, 78). È interessante notare come la diminuzione correlata alla dieta ricca di grassi di Bacteroidetes e l’aumento, sia di Firmicutes che di Proteobacteria, siano indipendenti dall’obesità (78), il che implica l’influenza della composizione della dieta, in particolare dei grassi, nella risposta della flora microbica. Inoltre, non c’erano differenze significative negli indicatori sierici di salute o del profilo microbico quando differenti fonti proteiche (manzo, caseina, soia) venivano consumate insieme ad una dieta a basso contenuto di grassi (61). I batteri Gram-negativi (come i Bacteroidetes) producono LPS (79, 80), un’endotossina che promuove l’infiammazione sistemica e l’endotossiemia metabolica, poiché può favorire la sovraespressione delle citochine proinfiammatorie una volta che, dall’intestino, raggiunge la circolazione sistemica (81, 82). Pochi studi condotti sugli animali hanno riportato una diminuzione della quantità relativa di Bacteroidetes in risposta ad una dieta con carne bovina se paragonata ad una dieta non purificata (57) o ad una dieta a base di caseina (10, 58). Inoltre, la proteina legante il LPS, un indicatore di danno della barriera intestinale, era più alta nel gruppo delle caseine rispetto ad altri gruppi con una dieta a basso contenuto di grassi (61). Pertanto, le diete ad elevato contenuto di grassi potrebbero essere fonte di maggiore preoccupazione rispetto a quelle contenenti fonti di proteine alimentari nell’avere un impatto negativo sul profilo microbico intestinale. Negli studi condotti sugli animali, una dieta contenente carne bovina ha aumentato la quantità relativa di Firmicutes (10, 57, 58), mentre ha fatto diminuire i Bacteroidetes (10, 57). In altre parole, la carne rossa può incrementare il rapporto Firmicutes/Bacteroidetes, che spesso viene associato all’aumento del BMI negli esseri umani (84, 85). Nei pochi studi condotti sull’uomo che abbiamo individuato durante la nostra ricerca in letteratura i risultati apparivano variabili, con modificazioni contraddittorie nella quantità relativa di Firmicutes riportata (63, 64). Inoltre, negli esseri umani, colture batteriche effettuate dopo diete ad elevato contenuto di carne bovina (380 g/d) hanno evidenziato aumenti significativi di Bacteroides (65), un genere del phylum Bacteroidetes. Secondo le Dietary Guidelines for Americans del 2015-2020, si consigliano 26 once/settimana (737 g/settimana) o ∼3.71 once/giorno (105 g/giorno) di proteine provenienti da fonti proteiche, tra cui carne, pollame e uova. Supponendo che 1 oz (28.35 g) di carne contenga ∼7 g di proteine, ciò equivale a ∼26 g di proteine/die da questa tipologia di alimento (68); tuttavia, le raccomandazioni sulle proteine possono variare a seconda delle necessità, e quindi più proteine provenienti da questo gruppo di alimenti potrebbero essere consumate per riuscire a soddisfare fabbisogni proteici superiori (2.5 g/kg/giorno) ad esempio, in base al peso corporeo (41). I divari tra le raccomandazioni sulle proteine e sulle quantità utilizzate negli studi sull’uomo denotano la necessità di valutare l’impatto della qualità e della quantità di proteine sul microbiota umano, specialmente in quelle popolazioni con un elevato apporto proteico, come gli atleti (86). La lavorazione, la preparazione e la conservazione degli alimenti influenzano le proprietà nutrizionali, funzionali, biologiche delle proteine e la loro digeribilità. Studi in vitro su colture di campioni fecali umani indicano che la tipologia di carne e il metodo di cottura hanno entrambi un impatto sul profilo microbico (87). Inoltre, i risultati negativi associati ad un eccessivo consumo di carne bovina includono quelli direttamente correlati alla cottura ad elevate temperature, che può causare la produzione di idrocarburi policiclici aromatici e di ammine eterocicliche (88), composti N-nitrosi generati come sottoprodotti microbici, o la presenza dell’acido sialico non umano N-glicolilneuraminico (89). Inoltre, i meccanismi che collegano la carne bovina allo sviluppo di malattie croniche non trasmissibili non sono del tutto chiari, ma potrebbero essere correlati lla presenza di alcuni micronutrienti, visto che il ferro e lo zinco sembrerebbero influenzare il profilo microbico (63). Ad esempio, diversi studi hanno esaminato l’effetto del ferro eme sulla salute e sulla composizione del microbiota; tuttavia, questi non possono essere letti direttamente come studi riguardanti l’alimentazione a base di carne bovina (90). Inoltre, anche se il contenuto di ferro può essere standardizzato quando si confrontano le diete proteiche, le proteine animali e vegetali contengono tipologie diverse di ferro (eme e non eme, rispettivamente), che possono avere un impatto differente sul profilo microbico intestinale. Di conseguenza, gli studi sull’eme e gli studi sulle proteine animali possono avere risultati contrastanti: un’assunzione elevata di eme si traduce in una diminuzione di Lactobacillus e in un aumento dei Proteobacteria (91), mentre le proteine estratte dalla carne di manzo esercitano un effetto opposto su Lactobacillus (10, 58). Il Lactobacillus viene considerato un attore chiave nel metabolismo energetico dell’ospite (92, 93) e nell’attenuazione dell’infiammazione, in quanto capace di far cambiare positivamente il profilo microbico intestinale e di proteggere la barriera intestinale (82, 94, 95). Questi risultati sottolineano l’impatto delle singole componenti presenti nella carne bovina (ad esempio, l’eme versus le proteine estratte dalla carne) rispetto alla carne bovina in toto sui profili microbici. Gli studi condotti sugli animali indicano diminuzioni significative di Lactobacillus nel caso di un’alimentazione a base di carne bovina ad elevato contenuto di grassi, rispetto ad una dieta a base caseina (61), e nel caso di un’alimentazione a base di carne bovina rispetto ad una dieta a base di carne di pollo (75). Una review sistematica dei composti dannosi associati alla carne rossa suggerisce la necessità di studi meglio progettati e controllati che utilizzino quantitativi pertinenti di carne, o di preparazioni a base di essa, unitamente a diete rappresentative di quelle adottate dall’uomo (97). Inoltre, sono stati esplorati metodi per prevenire la tossicità associata al consumo di carne rossa, ad esempio aumentando il calcio nella dieta, modificando la lavorazione della carne o aggiungendo vitamina E (98). Man mano che questi studi evolveranno, gli studi futuri sul microbioma e sul microbiota in seguito al consumo di carne bovina dovranno includere gli effetti di queste combinazioni, dei metodi di lavorazione e dell’impiego di additivi.
Prospettive future
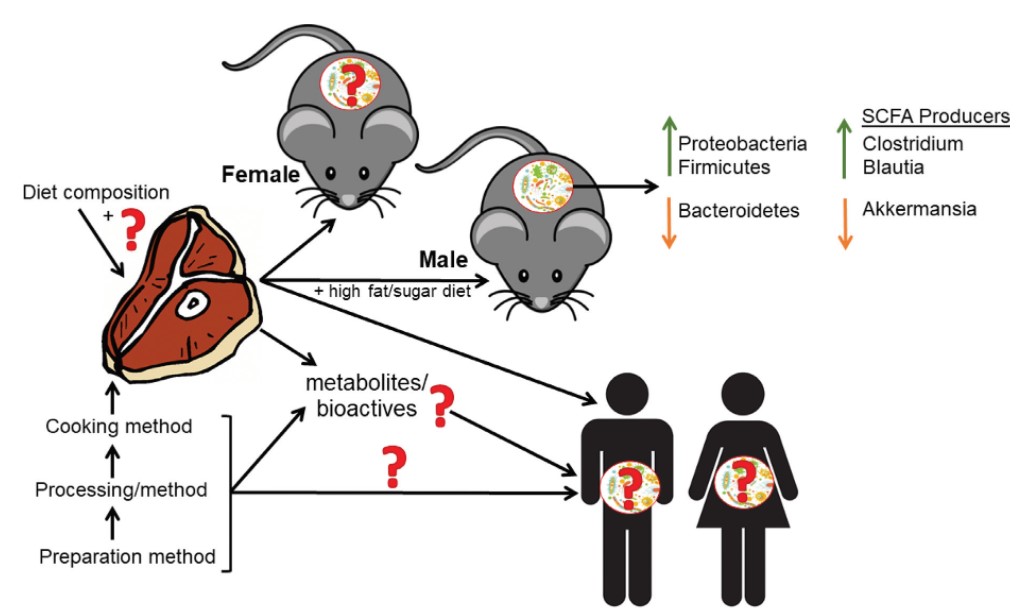
Sono necessari ulteriori studi per chiarire il ruolo del microbiota intestinale in seguito al consumo di carne bovina e, in particolare, per valutare l’interazione con altri gruppi alimentari come i grassi e i carboidrati (Figura 2). Saranno necessari studi condotti sia sugli animali che sull’uomo, per capire come i diversi metodi di preparazione, lavorazione e cottura della carne influenzino in maniera differente i suoi effetti biologici. Inoltre, le fonti proteiche di origine animale variano nella loro composizione, ad esempio in base al profilo degli acidi grassi, che viene ampiamente influenzato dalla dieta consumata dagli animali (99), e questa è una cosa da tenere bene in considerazione durante gli studi che confrontano i cambiamenti microbici e il rischio di sviluppare malattie croniche in risposta alla dieta (100). Per esempio, queste diete dovrebbero essere standardizzate per quanto riguarda il profilo degli acidi grassi e dei micronutrienti. Inoltre, sono state impiegate diverse tecniche per comprendere la digestione microbica delle proteine alimentari e dei composti bioattivi risultanti da esse, ma è necessario sviluppare tecniche più convenienti ed appropriate poiché esistono molti fattori in grado di influenzare questo processo, inclusa la presenza di altri macro e micronutrienti (40). Sono necessari anche studi di metabolomica relativi al microbioma per determinare l’impatto del consumo di carne bovina sui cambiamenti del microbiota intestinale e su come questi siano collegati con la fisiologia e la salute dell’ospite. Inoltre, nei modelli animali non è ben studiato come queste diete influenzino il metabolismo in modo tessuto-specifico. Sono necessari ulteriori studi meccanicistici per indagare il ruolo dei composti bioattivi della carne bovina, nel contesto di varie diete. Ad esempio, è stato dimostrato che la L-carnitina migliora l’effetto negativo delle diete ad elevato contenuto di grassi sul profilo lipidico nei ratti (101), ma si è anche dimostrata capace di far aumentare la produzione di sottoprodotti tossici (36). Il metabolismo di questi composti di derivazione proteica dipende in gran parte dalla composizione del microbiota del colon e dalla sua influenza sul metabolismo; pertanto, dovrebbero essere prese in considerazione analisi accoppiate dei composti bioattivi derivati da proteine e dei metaboliti microbici correlati. Gli SCFA sono i prodotti finali della digestione microbica di carboidrati e proteine nell’intestino crasso, e possono avere un impatto positivo sulla salute (102). La produzione di SCFA varia in base al profilo del microbiota – i batteri producono diversi SCFA in base alla preferenza del substrato – e anche alla tipologia di substrato non digerito che arriva nell’intestino crasso (103-105). Secondo la nostra conoscenza, soltanto 2 studi condotti sugli animali (dallo stesso gruppo di ricerca) hanno messo a confronto differenti estratti di proteine provenienti da diverse fonti per quanto riguardava la produzione di SCFA in relazione ai cambiamenti nella composizione del microbiota (58, 83). Ciascuno studio ha riportato una maggiore produzione di SCFA dopo il consumo di proteine della soia se paragonate alle proteine estratte da pollo e manzo (58, 83); tuttavia, ciò potrebbe essere dovuto alla limitata biodisponibilità della soia rispetto a quella delle proteine della carne (70). Diversi studi condotti sugli animali hanno dimostrato che l’amido resistente, insieme alla carne rossa, riduce il rischio di cancro al colon (106-108). Uno studio simile condotto sull’uomo dallo stesso gruppo di ricerca, ha evidenziato un aumento della produzione di SCFA e dei cambiamenti nel profilo del microbiota dopo una dieta con elevato contenuto di manzo (300 g/d) + amido di mais ad alto contenuto di amilosio butilato per 4 settimane (66). È interessante notare come l’omogenizzato di manzo, impiegato come alimento complementare nei neonati altrimenti allattati al seno, abbia fatto aumentare i batteri fecali che producono SCFA (63), cosa che potrebbe avere effetti nel corretto sviluppo del microbiota infantile, nel metabolismo dei nutrienti e nello sviluppo del sistema immunitario (109). Sono necessari studi futuri per indagare gli effetti combinati a lungo termine dell’amido e delle proteine della carne bovina (secondo le quantità raccomandate) sulla composizione del microbiota e sulla rispettiva produzione di SCFA, ed anche per indagare l’effetto di questa combinazione in individui in sovrappeso o in un contesto che preveda una dieta ad elevato contenuto di grassi/zuccheri.
FIGURA 2 – Esistono ampie lacune nella letteratura per quanto riguarda la carne bovina, i suoi composti bioattivi e gli effetti sul microbiota intestinale. Nella letteratura esaminata vengono utilizzate diverse preparazioni, metodi di lavorazione, di cottura e differenti temperature, che probabilmente hanno avuto un impatto sui componenti bioattivi contenuti nella carne bovina. I soggetti della ricerca variavano, per età e modelli utilizzati, dai roditori agli esseri umani. Gli effetti della carne bovina sui topi e sui ratti maschi erano per lo più concordanti, ed indicavano un aumento dei Proteobacteria e dei Firmicutes ed una diminuzione dei Bacteroidetes. I risultati relativi agli effetti sui generi batterici produttori di SCFA erano discordanti, con aumenti di Clostridium e Blautia e diminuzioni di Akkermansia. Il consumo di carne bovina per un breve periodo di tempo (1-4 settimane) ha avuto un effetto minimo o nullo sui profili microbici intestinali negli esseri umani. La maggior parte degli studi che presentavano risultati negativi (studi condotti sugli animali e sull’uomo) esaminava l’effetto della carne rossa, o di un consumo eccessivo di carne rossa, nel contesto di una dieta ricca di grassi/zuccheri.
Conclusioni
In conclusione, la carne bovina se viene consumata in quantitativi superiori rispetto a quelli raccomandati e come parte di una dieta ricca di zuccheri o grassi, potrebbe avere effetti negativi sul microbiota intestinale. Gli studi condotti sull’uomo indicano cambiamenti minimi nel profilo microbico intestinale in risposta ad una dieta a breve termine (1-4 wk) contenente carne bovina. In futuro saranno necessarie ulteriori ricerche: 1) per chiarire i cambiamenti del microbiota in risposta al consumo di carne bovina come tale (secondo le quantità raccomandate e in eccesso rispetto a quanto riportato dalle linee guida dietetiche) e in combinazione con altri nutrienti; 2) per condurre studi di metabolomica sul microbioma per capire come i suoi cambiamenti siano correlati alla fisiologia dell’ospite; 3) per indagare il ruolo dei composti bioattivi derivati dalla carne bovina nel contesto di varie diete; 4) per determinare se altri nutrienti, come i carboidrati complessi, possano migliorare alcuni effetti dannosi dovuti all’aumento del consumo di carne bovina nell’ambito di diete ad alto contenuto di grassi e/o di zuccheri; 5) per identificare le alterazioni nella produzione di SCFA in seguito al consumo di carne bovina; e 6) per sviluppare tecniche più convenienti e appropriate utili a comprendere meglio la digestione microbica delle proteine assunte con la dieta, che includano tipologie di alimenti come la carne bovina.
Systematic Review of Beef Protein Effects on Gut Microbiota: Implications for Health
Kembra Albracht-Schulte, Tariful Islam, Paige Johnson, Naima Moustaid-Moussa
Advances in Nutrition, Volume 12, Issue 1, January 2021, Pages 102–114, https://doi.org/10.1093/advances/nmaa085
Riferimenti
1. USDA. USDA agricultural projections to 2027. Washington (DC): United States Department of Agriculture; 2018.
2. Zeng L, Ruan M, Liu J,Wilde P, Naumova EN, Mozaffarian D, Zhang FF. Trends in processed meat, unprocessed red meat, poultry, and fish consumption in the United States, 1999–2016. J Acad Nutr Diet 2019;119(7):1085–98.e12.
3. Micha R, Michas G, Mozaffarian D. Unprocessed red and processed meats and risk of coronary artery disease and type 2 diabetes—an updated review of the evidence. Curr Atheroscler Rep 2012;14(6): 515–24.
4. JenabM, Slimani N, BictashM, Ferrari P, Bingham SA. Biomarkers in nutritional epidemiology: applications, needs and new horizons. Hum Genet 2009;125(5-6):507–25.
5. Millward DJ, Layman DK, Tome D, Schaafsma G. Protein quality assessment: impact of expanding understanding of protein and amino acid needs for optimal health. Am J Clin Nutr 2008;87(5):1576S.
6. Biesalski HK. Meat as a component of a healthy diet – are there any risks or benefits if meat is avoided in the diet? Meat Sci 2005;70(3):509–24.
7. Friedman M.Nutritional value of proteins fromdifferent food sources. a review. J Agric Food Chem 1996;44(1):6–29.
8. Lang JM, Pan C, Cantor RM, Tang WHW, Garcia-Garcia JC, Kurtz I, Hazen SL, Bergeron N, Krauss RM, Lusis AJ. Impact of individual traits, saturated fat, and protein source on the gut microbiome. Mbio [Internet] 2018;9(6). doi:10.1128/mBio.01604-18.
9. Reese AT, Pereira FC, Schintlmeister A, Berry D,WagnerM, Hale LP, Wu A, Jiang S,DurandHK, Zhou X, et al.Microbial nitrogen limitation in the mammalian large intestine. Nat Microbiol 2018;3(12):1441–50.
10. Zhu Y, Lin X, Zhao F, Shi X, Li H, Li Y, ZhuW, Xu X, Li C, Zhou G. Meat, dairy and plant proteins alter bacterial composition of rat gut bacteria. Sci Rep 2015;5:15220.
11. Turnbaugh PJ, Ley RE, Hamady M, Fraser-Liggett CM, Knight R, Gordon JI. The human microbiome project. Nature 2007;449(7164):804–10.
12. Tang WH, Kitai T, Hazen SL. Gut microbiota in cardiovascular health and disease. Circ Res 2017;120(7):1183–96.
13. Gopalakrishnan V, Helmink BA, Spencer CN, Reuben A, Wargo JA. The influence of the gut microbiome on cancer, immunity, and cancer immunotherapy. Cancer Cell 2018;33(4):570–80.
14. Wang T, Cai G, Qiu Y, Fei N, Zhang M, Pang X, Jia W, Cai S, Zhao L. Structural segregation of gut microbiota between colorectal cancer patients and healthy volunteers. ISME J 2012;6(2):320–9.
15. Jie Z, Xia H, Zhong SL, Feng Q, Li S, Liang S, Zhong H, Liu Z, Gao Y, Zhao H, et al. The gutmicrobiome in atherosclerotic cardiovascular disease. Nat Commun 2017;8(1):845.
16. Logan AC, Jacka FN, Prescott SL. Immune-microbiota interactions: dysbiosis as a global health issue. Curr Allergy Asthma Rep 2016;16(2):13.
17. Cox LM, Yamanishi S, Sohn J, Alekseyenko AV, Leung JM, Cho I, Kim SG, Li H, Gao Z, Mahana D, et al. Altering the intestinal microbiota during a critical developmental window has lasting metabolic consequences. Cell 2014;158(4):705–21.
18. Costea PI, Hildebrand F, Arumugam M, Backhed F, Blaser MJ, Bushman FD, de Vos WM, Ehrlich SD, Fraser CM, Hattori M, et al. Enterotypes in the landscape of gut microbial community
composition. Nat Microbiol 2018;3(1):8–16.
19. Rodriguez JM, Murphy K, Stanton C, Ross RP, Kober OI, Juge N, Avershina E, Rudi K, Narbad A, Jenmalm MC, et al. The composition of the gut microbiota throughout life, with an emphasis on early life. Microb Ecol Health Dis 2015;26:26050.
20. Carmody RN, Gerber GK, Luevano JM, Jr, Gatti DM, Somes L, Svenson KL, Turnbaugh PJ. Diet dominates host genotype in shaping the murine gut microbiota. Cell Host Microbe 2015;17(1):
72–84.
21. David LA, Maurice CF, Carmody RN, Gootenberg DB, Button JE, Wolfe BE, Ling AV, Devlin AS, Varma Y, Fischbach MA, et al. Diet rapidly and reproducibly alters the human gut microbiome. Nature 2014;505(7484):559–63.
22. Maier TV, Lucio M, Lee LH, VerBerkmoes NC, Brislawn CJ, Bernhardt J, Lamendella R, McDermott JE, Bergeron N, Heinzmann SS, et al. Impact of dietary resistant starch on the human gut microbiome, metaproteome, and metabolome. mBio [Internet] 2017;8(5). doi:10.1128/mBio.01343-17.
23. Yang X, Darko KO, Huang Y, He C, Yang H, He S, Li J, Li J, Hocher B, Yin Y. Resistant starch regulates gut microbiota: structure, biochemistry and cell signalling. Cell Physiol Biochem
2017;42(1):306–18.
24. Fava F, Gitau R, Griffin B, Gibson G, Tuohy K, Lovegrove J. The type and quantity of dietary fat and carbohydrate alter faecal microbiome and short-chain fatty acid excretion in a metabolic syndrome “at-risk” population. Int J Obes 2013;37(2):216–23.
25. Shen W, Gaskins HR, McIntosh MK. Influence of dietary fat on intestinal microbes, inflammation, barrier function and metabolic outcomes. J Nutr Biochem 2014;25(3):270–80.
26. Nicholson JK, Holmes E, Kinross J, Burcelin R, Gibson G, Jia W, Pettersson S. Host-gut microbiota metabolic interactions. Science 2012;336(6086):1262–7.
27. Gibson SA, McFarlan C, Hay S, MacFarlane GT. Significance of microflora in proteolysis in the colon. Appl Environ Microbiol 1989;55(3):679–83.
28. Macfarlane GT, Cummings JH, Allison C. Protein degradation by human intestinal bacteria. J Gen Microbiol 1986;132(6): 1647–56.
29. Smith EA, Macfarlane GT. Dissimilatory amino acid metabolism in human colonic bacteria. Anaerobe 1997;3(5):327–37.
30. Rowan AM, Moughan PJ, Wilson MN, Maher K, Tasman-Jones C. Comparison of the ileal and faecal digestibility of dietary amino acids in adult humans and evaluation of the pig as a model animal for digestion studies in man. Br J Nutr 1994;71(1):29–42.
31. Chacko A, Cummings JH. Nitrogen losses from the human small bowel: obligatory losses and the effect of physical form of food. Gut 1988;29(6):809–15.
32. Gibson JA, Sladen GE, Dawson AM. Protein absorption and ammonia production: the effects of dietary protein and removal of the colon. Br J Nutr 1976;35(1):61–5.
33. Van der Meulen R, Camu N, Van Vooren T, Heymans C, De Vuyst L. In vitro kinetic analysis of carbohydrate and aromatic amino acid metabolism of different members of the human colon. Int J Food Microbiol 2008;124(1):27–33.
34. Tuohy KM, Hinton DJ, Davies SJ, Crabbe MJ, Gibson GR, Ames JM. Metabolism of Maillard reaction products by the human gut microbiota—implications for health. Mol Nutr Food Res
2006;50(9):847–57.
35. Yamamoto N. Antihypertensive peptides derived from food proteins. Biopolymers 1997;43(2):129–34.
36. Koeth RA, Wang Z, Levison BS, Buffa JA, Org E, Sheehy BT, Britt EB, Fu X, Wu Y, Li L, et al. Intestinal microbiota metabolism of Lcarnitine, a nutrient in red meat, promotes atherosclerosis. Nat Med 2013;19(5):576–85.
37. KittsDD,Weiler K. Bioactive proteins and peptides fromfood sources. Applications of bioprocesses used in isolation and recovery. Curr Pharm Des 2003;9(16):1309–23.
38. Schrezenmeir J, Korhonen H, Williams CM, Gill HS, Shah NP. Foreword. Br J Nutr 2000;84(1):1.
39. Daliri EB, Oh DH, Lee BH. Bioactive peptides. Foods [Internet] 2017;6(5). doi:10.3390/foods6050032.
40. Chakrabarti S, Guha S, Majumder K. Food-derived bioactive peptides in human health: challenges and opportunities. Nutrients 2018;10(11):1738.
41. Institute of Medicine. Dietary Reference Intakes for energy, carbohydrate, fiber, fat, fatty acids, cholesterol, protein, and amino acids (macronutrients).Washington (DC): National Academies Press; 2005.
42. Möller NP, Scholz-Ahrens KE, Roos N, Schrezenmeir J. Bioactive peptides and proteins from foods: indication for health effects. Eur J Nutr 2008;47(4):171–82.
43. Admassu H, Gasmalla MAA, Yang R, Zhao W. Bioactive peptides derived from seaweed protein and their health benefits: antihypertensive, antioxidant, and antidiabetic properties. J Food Sci
2018;83(1):6–16.
44. Chakrabarti S, Jahandideh F, Wu J. Food-derived bioactive peptides on inflammation and oxidative stress. Biomed Res Int 2014;2014:1.
45. Rutherfurd-Markwick KJ. Food proteins as a source of bioactive peptides with diverse functions. Br J Nutr 2012;108(Suppl 2):S149–57.
46. Giromini C, Cheli F, Rebucci R, Baldi A. Invited review: dairy proteins and bioactive peptides: modeling digestion and the intestinal barrier. J Dairy Sci 2019;102(2):929–42.
47. Halim NRA, Yusof HM, Sarbon NM. Functional and bioactive properties of fish protein hydrolysates and peptides: a comprehensive review. Trends Food Sci Tech 2016;51:24–33.
48. Agyei D. Bioactive proteins and peptides from soybeans. Recent Pat Food Nutr Agric 2015;7(2):100–7.
49. Boldyrev AA, Severin SE. The histidine-containing dipeptides, carnosine and anserine: distribution, properties and biological significance. Adv Enzyme Regul 1990;30:175–94.
50. Bouckenooghe T, Remacle C, Reusens B. Is taurine a functional nutrient? Curr Opin Clin Nutr Metab Care 2006;9(6):728–33.
51. Rakowska R, Sadowska A, Waszkiewicz-Robak B. Influence of preand post-slaughter factors on the reduced glutathione content of beef muscles. Meat Sci 2017;124:48–53.
52. Wu G, Cross HR, Gehring KB, Savell JW, Arnold AN, McNeill SH. Composition of free and peptide-bound amino acids in beef chuck, loin, and round cuts. J Anim Sci 2016;94(6):2603–13.
53. Etherington DJ. Enzymes in food processing. London: Blackie; 1991.
54. Purchas RW, Rutherfurd SM, Pearce PD, Vather R, Wilkinson BH. Cooking temperature effects on the forms of iron and levels of several other compounds in beef semitendinosus muscle. Meat Sci 2004;68(2):201–7.
55. Bauchart C, Rémond D, Chambon C, Patureau Mirand P, Savary- Auzeloux I, Reynès C, Morzel M. Small peptides (<5kDa) found in ready-to-eat beef meat. Meat Sci 2006;74(4):658–66.
56. Shamseer L, Moher D, Clarke M, Ghersi D, Liberati A, Petticrew M, Shekelle P, Stewart LA. Preferred reporting items for systematic reviewandmeta-analysis protocols (PRISMA-P) 2015: elaboration and explanation. BMJ 2015;349:g7647.
57. Zhang Z, Li D, Tang R. Changes in mouse gut microbial community in response to the different types of commonly consumed meat. Microorganisms 2019;7(3):76.
58. Zhu Y, Lin X, LiH, Li Y, Shi X, Zhao F, Xu X, Li C, Zhou G. Intake of meat proteins substantially increased the relative abundance of genus Lactobacillus in rat feces. PLoS One 2016;11(4):e0152678.
59. Schutkowski A, König B, Kluge H, Hirche F, Henze A, Schwerdtle T, Lorkowski S, Dawczynski C, Gabel A, Große I, et al. Metabolic footprint and intestinal microbial changes in response to dietary proteins in a pig model. J Nutr Biochem 2019;67:149–60.
60. Bedani R, Pauly-Silveira ND, Roselino MN, de Valdez GF, Rossi EA. Effect of fermented soy product on the fecal microbiota of rats fed on a beef-based animal diet. J Sci Food Agric 2010;90(2):233–8.
61. Ijaz MU, Ahmed MI, Zou X, Hussain M, Zhang M, Zhao F, Xu X, Zhou G, Li C. Beef, casein, and soy proteins differentially affect lipid metabolism, triglycerides accumulation and gut microbiota of high-fat diet-fed C57BL/6J mice. Front Microbiol 2018;9:2200.
62. Le Leu RK, Young GP, Hu Y, Winter J, Conlon MA. Dietary red meat aggravates dextran sulfate sodium-induced colitis in mice whereas resistant starch attenuates inflammation. Dig Dis Sci
2013;58(12):3475–82.
63. Krebs NF, Sherlock LG, Westcott J, Culbertson D, Hambidge KM, Feazel LM, Robertson CE, Frank DN. Effects of different complementary feeding regimens on iron status and enteric microbiota in breastfed infants. J Pediatr 2013;163(2):416–23.
64. Moreno-Perez D, Bressa C, Bailen M, Hamed-Bousdar S, Naclerio F, CarmonaM, Perez M, Gonzalez-Soltero R,Montalvo-LomincharMG, Carabana C, et al. Effect of a protein supplement on the gut microbiota of endurance athletes: a randomized, controlled, double-blind pilot
study. Nutrients 2018;10(3):337.
65. Hentges DJ, Maier BR, Burton GC, Flynn MA, Tsutakawa RK. Effect of a high-beef diet on the fecal bacterial flora of humans. Cancer Res 1977;37(2):568–71.
66. Le Leu RK, Winter JM, Christophersen CT, Young GP, Humphreys KJ, Hu Y, Gratz SW, Miller RB, Topping DL, Bird AR, et al. Butyrylated starch intake can prevent red meat-induced O6-methyl-2-deoxyguanosine adducts in human rectal tissue: a randomised clinical trial. Br J Nutr 2015;114(2):220–30.
67. Lunn JC, Kuhnle G, Mai V, Frankenfeld C, Shuker DE, Glen RC, Goodman JM, Pollock JR, Bingham SA. The effect of haem in red and processed meat on the endogenous formation of Nnitroso compounds in the upper gastrointestinal tract. Carcinogenesis 2007;28(3):685–90.
68. US Department of Health and Human Services and US Department of Agriculture. 2015–2020 dietary guidelines for Americans. 8th ed [Internet]. 2015. Retrieved 2020 Feb 1 from: https://health.gov/ourwork/food-nutrition/2015-2020-dietary-guidelines/guidelines/.
69. Pereira PM, Vicente AF. Meat nutritional composition and nutritive role in the human diet. Meat Sci 2013;93(3):586–92.
70. Gilbert JA, BendsenNT, Tremblay A, Astrup A. Effect of proteins from different sources on body composition. Nutr Metab Cardiovasc Dis 2011;21(Suppl 2):B16–31.
71. Hills RD, Jr, Pontefract BA, Mishcon HR, Black CA, Sutton SC, Theberge CR. Gut microbiome: profound implications for diet and disease. Nutrients [Internet] 2019;11(7). doi:10.3390/nu11071613.
72. Hall KD, Ayuketah A, Brychta R, Cai H, Cassimatis T, Chen KY, Chung ST, Costa E, Courville A, Darcey V, et al. Ultra-processed diets cause excess calorie intake and weight gain: an inpatient randomized controlled trial of ad libitum food intake. Cell Metab 2019;30(1):67–77.e3.
73. Klurfeld DM. Research gaps in evaluating the relationship ofmeat and health. Meat Sci 2015;109:86–95.
74. Binnie MA, Barlow K, Johnson V, Harrison C. Redmeats: time for a paradigm shift in dietary advice. Meat Sci 2014;98(3):445–51.
75. Van Hecke T, De Vrieze J, Boon N, De Vos WH, Vossen E, De Smet S. Combined consumption of beef-based cooked mince and sucrose stimulates oxidative stress, cardiac hypertrophy, and colonic outgrowth of Desulfovibrionaceae in rats. Mol Nutr Food Res 2019;63(2):e1800962.
76. Shin NR, Whon TW, Bae JW. Proteobacteria: microbial signature of dysbiosis in gut microbiota. Trends Biotechnol 2015;33(9):496–503.
77. Tachon S, Lee B, Marco ML. Diet alters probiotic Lactobacillus persistence and function in the intestine. Environ Microbiol 2014;16(9):2915–26.
78. Hildebrandt MA, Hoffmann C, Sherrill-Mix SA, Keilbaugh SA, Hamady M, Chen YY, Knight R, Ahima RS, Bushman F, Wu GD. High-fat diet determines the composition of the murine gut microbiome independently of obesity. Gastroenterology 2009;137(5):1716.
79. Weiss J. Bactericidal/permeability-increasing protein (BPI) and lipopolysaccharide-binding protein (LBP): structure, function and regulation in host defence against Gram-negative bacteria. Biochem Soc Trans 2003;31(4):785–90.
80. Lindberg AA, Weintraub A, Zahringer U, Rietschel ET. Structureactivity relationships in lipopolysaccharides of Bacteroides fragilis. Rev Infect Dis 1990;12(Suppl 2):S133–41.
81. Zweigner J, Schumann RR,Weber JR. The role of lipopolysaccharidebinding protein in modulating the innate immune response.Microbes Infect 2006;8(3):946–52.
82. Cani PD, Bibiloni R, Knauf C, Waget A, Neyrinck AM, Delzenne NM, Burcelin R. Changes in gut microbiota control metabolic endotoxemia-induced inflammation in high-fat diet-induced obesity and diabetes in mice. Diabetes 2008;57(6):1470–81.
83. Zhu Y, Shi X, Lin X, Ye K, Xu X, Li C, Zhou G. Beef, chicken, and soy proteins in diets induce different gut microbiota and metabolites in rats. Front Microbiol 2017;8:1395.
84. Koliada A, Syzenko G, Moseiko V, Budovska L, Puchkov K, Perederiy V, Gavalko Y, Dorofeyev A, RomanenkoM, Tkach S, et al. Association between body mass index and Firmicutes/Bacteroidetes ratio in an adult Ukrainian population. BMC Microbiol 2017;17(1):120.
85. Tseng C-H, Wu C-Y. The gut microbiome in obesity. J Formos Med Assoc 2019;118:S3–9.
86. Thomas DT, Erdman KA, Burke LM. American College of Sports Medicine joint position statement: nutrition and athletic performance. Med Sci Sports Exerc 2016;48(3):543–68.
87. Shen Q, Chen YA, Tuohy KM.Acomparative in vitro investigation into the effects of cookedmeats on the human faecalmicrobiota. Anaerobe 2010;16(6):572–7.
88. Abid Z, Cross AJ, Sinha R. Meat, dairy, and cancer. Am J Clin Nutr 2014;100(Suppl 1):386S.
89. Samraj AN, Pearce OMT, Läubli H, Crittenden AN, Bergfeld AK, Banda K, Gregg CJ, Bingman AE, Secrest P, Diaz SL, et al. A red meatderived glycan promotes inflammation and cancer progression. Proc Natl Acad Sci U S A 2015;112(2):542–7.
90. Cross AJ, Pollock JR, Bingham SA. Haem, not protein or inorganic iron, is responsible for endogenous intestinal N-nitrosation arising from red meat. Cancer Res 2003;63(10):2358–60.
91. Constante M, Fragoso G, Calvé A, Samba-Mondonga M, Santos MM. Dietary heme induces gut dysbiosis, aggravates colitis, and potentiates the development of adenomas in mice. Front Microbiol
2017;8(1809):1809.
92. Marco ML, de Vries MC, Wels M, Molenaar D, Mangell P, Ahrne S, de Vos WM, Vaughan EE, Kleerebezem M. Convergence in probiotic Lactobacillus gut-adaptive responses in humans and mice. ISME J 2010;4(11):1481–4.
93. Arora T, Anastasovska J, Gibson G, Tuohy K, Sharma RK, Bell J, FrostG. Effect of Lactobacillus acidophilusNCDC13 supplementation on the progression of obesity in diet-induced obese mice. Br J Nutr 2012;108(8):1382–9.
94. Cani PD, Amar J, Iglesias MA, Poggi M, Knauf C, Bastelica D, Neyrinck AM, Fava F, Tuohy KM, Chabo C, et al. Metabolic endotoxemia initiates obesity and insulin resistance. Diabetes
2007;56(7):1761–72.
95. Wang W, Li Q, Chai W, Sun C, Zhang T, Zhao C, Yuan Y, Wang X, Liu H, Ye H. Lactobacillus paracasei Jlus66 extenuate oxidative stress and inflammation via regulation of intestinal flora in rats with non alcoholic fatty liver disease. Food Sci Nutr 2019;7(8):2636–46.
96. WilliamsBA, ZhangD,LisleAT,MikkelsenD,McSweeneyCS, Kang S, Bryden WL, GidleyMJ. Soluble arabinoxylan enhances large intestinal microbial health biomarkers in pigs fed a red meat-containing diet. Nutrition 2016;32(4):491–7.
97. Turner ND, Lloyd SK.Association between red meat consumption and colon cancer: a systematic reviewof experimental results. Exp BiolMed (Maywood) 2017;242(8):813–39.
98. CorpetDE. Red meat and colon cancer: shouldwe become vegetarians, or can we make meat safer? Meat Sci 2011;89(3):310–6.
99. Smet SD, Raes K, Demeyer D. Meat fatty acid composition as affected by fatness and genetic factors: a review. Anim Res 2004;53(2):81–98.
100. McNeill SH, Harris KB, Field TG, Van Elswyk ME. The evolution of lean beef: identifying lean beef in today’s U.S. marketplace. Meat Sci 2012;90(1):1–8.
101. Amin KA, Nagy MA. Effect of carnitine and herbal mixture extract on obesity induced by high fat diet in rats. Diabetol Metab Syndr [Internet] 2009;1(1):17. doi:10.1186/1758-5996-1-17.
102. Adolph TE, Mayr L, Grabherr F, Schwarzler J, Tilg H. Pancreasmicrobiota cross talk in health and disease. Annu Rev Nutr 2019;39:249–66.
103. Birt DF, Boylston T, Hendrich S, Jane JL, Hollis J, Li L, McClelland J, Moore S, Phillips GJ, Rowling M, et al. Resistant starch: promise for improving human health. Adv Nutr 2013;4(6):587–601.
104. van Hylckama Vlieg JE, Veiga P, Zhang C, Derrien M, Zhao L. Impact of microbial transformation of food on health – fromfermented foods to fermentation in the gastro-intestinal tract. Curr Opin Biotechnol 2011;22(2):211–9.
105. Rist VT, Weiss E, Eklund M, Mosenthin R. Impact of dietary protein on microbiota composition and activity in the gastrointestinal tract of piglets in relation to gut health: a review. Animal 2013;7(7):1067–78.
106. Winter J, Nyskohus L, Young GP, Hu Y, Conlon MA, Bird AR, Topping DL, Le Leu RK. Inhibition by resistant starch of red meatinduced promutagenic adducts in mouse colon. Cancer Prev Res2011;4(11):1920–8.
107. Toden S, Bird AR, Topping DL, Conlon MA. Dose-dependent reduction of dietary protein-induced colonocyte DNA damage by resistant starch in rats correlatesmore highly with caecal butyrate than with other short chain fatty acids. Cancer Biol Ther 2007;6(2):253–8.
108. O’Callaghan NJ, Toden S, Bird AR, Topping DL, Fenech M, Conlon MA. Colonocyte telomere shortening is greater with dietary red meat than white meat and is attenuated by resistant starch. Clin Nutr 2012;31(1):60–4.
109. Frank DN, Zhu W, Sartor RB, Li E. Investigating the biological and clinical significance of human dysbioses. Trends Microbiol 2011;19(9):427–34.






































































Scrivi un commento
Devi accedere, per commentare.