- Abstract
- Introduzione
- Metodi
- Effetti cardiometabolici di micro e macro nutrienti presenti nei latticini: evidenze dagli studi clinici
- I latticini e la controversia sui grassi saturi
- Effetti protettivi delle matrici di prodotti lattiero-caseari
- Discussione
- Riferimenti
Abstract
Il latte vaccino ed i relativi prodotti lattiero-caseari sono stati a lungo dichiarati benefici per la salute umana, ma le prove cliniche relative all’esistenza di un beneficio diretto continuano a sollevare dubbi. Esistono poche prove a supporto degli effetti positivi a livello cardiometabolico che potrebbero avere una serie di componenti (macro e micronutrienti) contenute nel del latte, tra cui le proteine del siero di latte e la caseina, i grassi insaturi, la membrana dei globuli di grasso del latte (MFGM) e i fosfolipidi polari, la vitamina D e il calcio, oltre ad altre componenti come i probiotici derivati da batteri e lieviti. Le componenti più controverse sono le frazioni lipidiche rappresentate dai grassi trans, tra cui l’acido vaccenico trans, l’acido palmitoleico trans e l’acido linoleico coniugato (CLA), oltre ai grassi del latte a catena media e a catena dispari. Nuove prove stanno rapidamente identificando i molteplici pathway attraverso i quali questi nutrienti dei latticini potrebbero avere effetti sulla salute. Anche la lavorazione dei latticini, comprese la fermentazione e l’omogeneizzazione, potrebbe avere effetti positivi. Invece, l’elevato contenuto di grassi saturi dei latticini ha destato a lungo preoccupazione, in linea con le linee guida internazionali che spingono per ridurre al minimo l’assunzione dietetica di acidi grassi saturi di origine animale (SFA) al fine di ottenere una migliore salute cardiometabolica. Tuttavia, sulla scia di studi osservazionali e di meta-analisi che dimostrano come i latticini non abbiano nessuna correlazione, o addirittura in alcuni casi abbiano una correlazione inversa, con la salute cardiometabolica, negli ultimi 5 anni sono state esaminate le prove ottenute da studi randomizzati controllati (RCT) e il focus sui latticini a basso contenuto di grassi è stato messo in discussione. Prove recenti supportano l’ipotesi che gli effetti negativi dei SFA sulla salute metabolica possano essere migliorati quando questi grassi vengono consumati all’interno di una matrice complessa come latte, formaggio o yogurt, e che le categorie di latticini possono influenzare i risultati tanto quanto il contenuto di grassi totali. Ad esempio, yogurt e formaggio ad elevato contenuto di grassi e di SFA hanno un’associazione negativa con il rischio di diabete di tipo 2 (T2D) in molti studi pubblicati, ma non in tutti. Tuttavia, mancano RCT di lunga durata su grandi campioni di consumo di latticini con incidenza di malattie cardiovascolari (CVD) o T2D come endpoint primari. Questa è un’evidente lacuna della ricerca, che sottolinea la necessità di studi clinici per confermare l’eventuale legame causale tra latticini e miglioramento della salute cardiometabolica e, a sua volta, per promuoverlo mediante la realizzazione di linee guida dietetiche. Le attuali raccomandazioni dei gruppi nazionali come l’American Heart Association (AHA) e la European Society of Cardiology (ESC) continuano a promuovere il consumo di latticini a basso contenuto di grassi, mentre il latte e lo yogurt rimangono a far parte delle linee guida nutrizionali contenute nel report della American Diabetes Association (ADA)/European Association for Study of Diabetes (EASD), e come parte della risposta “non esiste una soluzione che vada bene per tutti” alla dieta ed al T2D da parte dell’ADA nel loro più recente Consensus Report del 2019.
Parole chiave: grasso, proteina, latticini, malattie cardiovascolari, diabete, cardiometabolico.
Introduzione
Il latte vaccino e derivati da questo alimento complesso sono stati per lungo tempo considerati come alimenti benefici per la salute dell’uomo, ma le prove cliniche a sostegno di un beneficio diretto per la salute cardiometabolica continuano a sollevare polemiche, che si basano principalmente sull’elevato contenuto di acidi grassi saturi (SFA) all’interno dell’insieme dei grassi presenti nei latticini. Il fatto che gli elevati livelli di SFA alimentari da soli inneschino effettivamente un peggioramento della cascata di marcatori ematici intermedi, incluso un profilo lipoproteico indesiderato, e a loro volta portino ad una maggiore percentuale di comparsa di malattie cardiometaboliche, è ad oggi sotto esame approfondito. Questa review narrativa mira a presentare le prove più recenti provenienti sia da studi osservazionali di coorte che da studi randomizzati controllati (RCT) che analizzano le associazioni tra i latticini e il rischio di malattie cardiovascolari (CVD) e di diabete di tipo 2 (T2D), al fine di valutare le prove fornite da queste diverse tipologie di studio. Questo anche per individuare, ove possibile, i potenziali meccanismi mediante i quali i nutrienti contenuti nei latticini possono andare ad apportare benefici per la salute. La preoccupazione verso i latticini e i potenziali effetti dannosi che avrebbero per la salute deriva da precedenti dati epidemiologici, che sostenevano una forte associazione tra i gruppi di alimenti di origine animale contenenti un quantitativo importante di SFA e l’aumentato del rischio di CVD (1). In paesi come il Regno Unito, latte e latticini contribuiscono per quasi il 30% all’assunzione di SFA, quindi con una certa ragione sono stati considerati un componente della dieta preoccupante (2). Tuttavia, l’attuale letteratura evidenzia il crescente sostegno verso la proposta che i prodotti lattiero-caseari possano avere un effetto neutro, o addirittura benefico, sugli esiti di CVD (3), con una serie di meta-analisi a supporto di questa correlazione (4–9). C’è anche un nuovo, e crescente, consenso sul fatto che la matrice di un alimento, come nel caso dei latticini, possa essere più importante del contenuto e della composizione dei singoli acidi grassi isolati da esseo. Tanto che le raccomandazioni sulla salute CV dovrebbero essere sviluppate basandosi sull’alimento in toto piuttosto che sui nutrienti presenti al suo interno (3, 10, 11). Tuttavia, è da notare il fatto che la predominanza di queste evidenze provenga da studi osservazionali. Meno prove provengono dai RCT, in particolare se facciamo riferimento all’incidenza di CVD per la quale mancano interventi a lungo termine sui latticini che valutino difficili endpoint CV. Questo potrebbe rappresentare una criticità quando si mira ad interpretare i risultati che indicano una relazione positiva con i latticini regolari e con quelli ad elevato contenuto di grassi allo scopo di sviluppare efficaci raccomandazioni per la salute pubblica. Una serie di meta-analisi e review sistematiche si sono concentrate anche sui latticini e il T2D (4, 12-17), mostrando ancora una volta l’esistenza di un’associazione inversa tra il consumo di latticini e il rischio di T2D negli studi osservazionali. Un recente position paper di un gruppo di esperti (18) ha riportato una serie di risultati chiave tra cui la prova, ottenuta da ampi studi prospettici di coorte, che il consumo di latticini totali ha un effetto neutro o moderatamente benefico sul rischio di T2D. Di nuovo, questo è un risultato supportato solamente da prove limitate e provenienti da studi randomizzati controllati (RCT) (19), senza interventi a lungo termine che indaghino l’effetto dei latticini ad elevato contenuto di grassi sull’incidenza di T2D. La categoria dei latticini è chiaramente importante, ancora una volta secondo le prove ottenute da studi prospettici di coorte che dimostrano come lo yogurt fermentato sia strettamente associato ad un minor rischio di T2D. Anche nel 2020, il bilancio delle prove ottenute si basa prevalentemente su studi osservazionali. Sono necessari trial clinici d’intervento più ampi e di più lunga durata, con l’incidenza del T2D come esito primario. I RCT sono necessari anche per comprendere meglio i meccanismi secondo i quali i latticini potrebbero avere effetti potenzialmente protettivi. Ad esempio in una tipica dieta americana, i latticini rappresentano circa il 10% dell’energia consumata, metà della quale proviene all’incirca da latte fluido, metà dal formaggio fermentato (o “stagionato”) e una piccola percentuale da yogurt fermentato (20). Gli importanti nutrienti presenti all’interno della miriade di formati di latticini comprendono le proteine del latte, il calcio, il magnesio, il potassio, i grassi saturi a catena media e a catena dispari, specifici acidi grassi e gli zuccheri a basso indice glicemico (GI); si sono dimostrati in grado di avere effetti benefici su aspetti relativi al controllo del glucosio, alla secrezione di insulina, alla sensibilità all’insulina e/o sul rischio di T2D (21), nonché su una serie di fattori di rischio CV (22). In particolare, un certo numero di autori (23-26) ha recentemente evidenziato l’importanza di concentrare la propria attenzione sugli alimenti e sui modelli dietetici piuttosto che soltanto sui singoli nutrienti degli alimenti quando si valuta il rischio di CVD e T2D. Di conseguenza è chiaro come sia importante ampliare la risposta a questi schemi dietetici al di là del semplice grasso corporeo e della circolazione ematica dei lipidi quando si prendono in esame i molteplici esiti di rischio oggi identificati come importanti per la salute cardiovascolare.
Metodi
È stata condotta una ricerca in letteratura utilizzando MEDLINE (tramite PubMed) per individuare studi di coorte osservazionali e studi di intervento che avessero analizzato l’associazione tra consumo di latticini e salute cardiometabolica. I Medical Subjects Headings (MeSH) includevano latticini, latte, burro, formaggio, yogurt, CVD, diabete; le review, comprese le review sistematiche, meta-analisi, review ombrello e review narrative.
Effetti cardiometabolici di micro e macro nutrienti presenti nei latticini: evidenze dagli studi clinici
Proteine dei latticini
Siero e caseina
Tra le varie tipologie di alimenti proteici di origine animale, è stato visto che un maggior consumo di latticini ricchi di proteine sembrerebbe avere una correlazione benefica con una serie di endpoint CV, oltre al fatto che regolerebbe il glucosio e la diminuzione del rischio di T2D (16, 19, 27, 28). Le proteine del latte vengono classificate in due gruppi, in base alla solubilità, come proteine del siero (o del siero di latte) e caseine. Le proteine del siero di latte rimangono solubili a pH 4.6 e a 20° C, mentre le caseine precipitano (“cagliata”). Le proprietà molecolari e fisico-chimiche delle proteine del siero di latte e delle caseine sono molto diverse, con un rapporto proteine del siero totali:caseina totale nel latte vaccino di ∼20:80% (29). Sebbene esista una serie di grandi studi di coorte osservazionali a supporto dell’associazione tra una maggiore assunzione di latticini e un rischio neutro o basso di eventi cardiovascolari avversi per la salute, i dati provenienti da questi studi sulle proteine del siero di latte e sulla caseina sono di per sé scarsi. Esistono tuttavia diverse review sistematiche di RCT che hanno individuato gli effetti positivi delle proteine del siero di latte. Wirunsawanya et al., hanno recentemente riferito sull’integrazione di siero di latte e sugli endpoint CV in 9 RCT con coorti in sovrappeso e obese, ed hanno individuato un miglioramento nelle lipoproteine sieriche, per quanto concerneva il colesterolo totale e il l’HDL, oltre ad un miglioramento della pressione sanguigna (30), sebbene questi effetti fossero probabilmente guidati dalla perdita di peso corporeo. Esiste una sempre maggiore letteratura sugli effetti positivi delle proteine del siero di latte sull’ipertensione, dove si presuppone che i meccanismi coinvolti includano l’inibizione dell’enzima di conversione dell’angiotensina (ACE), la normalizzazione della funzione endoteliale e gli effetti dipendenti dai recettori per gli oppioidi, sebbene non tutti gli studi mostrino risultati positivi a lungo termine (31). Recentemente una review sistematica completa di Badely et al. che coinvolgeva > 2.000 individui da 37 RCT pubblicati (sempre adulti in sovrappeso e obesi), ha mostrato che le proteine del siero di latte somministrate in forme diverse tra cui isolato, concentrato, estratto, integratore e idrolizzato di proteine, hanno avuto un effetto positivo su diversi marker CV. Hanno riportato una diminuzione dei trigliceridi e della pressione sanguigna a digiuno, ma anche una diminuzione indesiderata del colesterolo HDL (32). Pur non riportando cambiamenti del peso corporeo, questi risultati erano accompagnati da una diminuzione della circonferenza della vita, una misura indiretta dell’adiposità addominale che dovrebbe essere accompagnata anche da una perdita di peso. Per lungo tempo è stato dimostrato che le proteine del siero di latte hanno modesti effetti positivi sulla composizione corporea durante la perdita di peso (33), ma resta da dimostrare in modo convincente se queste proteine abbiano un effetto sugli endpoint CV indipendentemente dal cambiamento del peso corporeo. Precedenti studi osservazionali hanno riportato effetti non dipendenti dal peso dell’assunzione totale di proteine sulla salute cardiometabolica, con gli autori che a loro volta hanno notato come il ruolo delle proteine nella salute CV dipendesse probabilmente dalla specifica fonte proteica (34). La prova che i latticini ricchi di proteine possano essere utili in caso di T2D è venuta in gran parte da studi osservazionali (27), nei quali nuovamente l’attribuzione di effetti positivi da parte delle proteine del latte sulla salute metabolica rimane equivoca. In particolare, la correlazione tra l’aumento dell’assunzione di proteine totali dalla dieta e gli endpoint cardiometabolici non è priva di controversie (35, 36), in particolare per quanto riguarda il T2D, in quanto alcuni studi di coorte mostrano che un elevato apporto di proteine totali o di proteine animali, comprese alcune proteine derivanti dai latticini (40), è associato ad un aumentato del rischio di questa malattia (37–39). Chiaramente la fonte e la qualità delle proteine sono di notevole importanza quando vogliono determinare delle linee guida dietetiche per la prevenzione del T2D. Le prove cliniche dei RCT riguardanti sia i latticini che le proteine del latte indicano interventi ad ampio raggio che riportano un aumento della secrezione di insulina e degli endpoint associati che, a loro volta, potrebbero portare ad un miglioramento del controllo glicemico. Wirunsawanya e colleghi, durante la loro meta-analisi sulle proteine del siero di latte da nove RCT sui soggetti in sovrappeso ed obesi menzionati in precedenza, hanno mostrato un miglioramento significativo del glucosio a digiuno, anche se in concomitanza di una diminuzione parallela del peso corporeo (30). Badely et al., hanno riportato anche dei miglioramenti relativi alla glicemia nella loro review sistematica di 37 studi di intervento sulle proteine del siero di latte condotti su individui in sovrappeso e obesi (32), ma ancora una volta non hanno determinato se questo dipendesse dalla perdita di peso. Questo insieme di prove si basa prevalentemente su studi di breve durata relativi agli endpoint metabolici intermedi piuttosto che su studi a lungo termine sulla prevenzione dell’incidenza del T2D, con interventi a lungo termine con proteine del latte sugli endpoint del T2D o sulla mancanza di incidenza. Attraverso la revisione dei registri di studi clinici internazionali possiamo identificare due studi che pianificavano di indagare un intervento a moderato termine con le proteine del siero di latte per la gestione del T2D della durata di 3 mesi. Almario et al. che hanno pubblicato effetti acuti (41) non sono stati in grado di intraprendere il processo a causa di cambiamenti di personale [informazioni gentilmente fornite dai ricercatori; (42)]. Jakubowicz et al. (43) hanno mostrato una diminuzione sia del glucosio postprandiale che dell’HbA1c nel gruppo ad elevato consumo di proteine del siero di latte rispetto al gruppo di controllo con basso consumo di proteine derivate dalla soia. In particolare, gli interventi dietetici a lungo termine per la prevenzione del T2D in soggetti in sovrappeso e ad alto rischio, fino ad oggi si sono concentrati quasi esclusivamente sulla manipolazione dei grassi e dei carboidrati della dieta (44). PREVIEW (PREVention of diabete through lifestyle surgery In Europe and around the World), un grande gruppo di studio europeo costituito da 2.500 partecipanti con RCT di 3 anni, è il primo studio a lungo termine nato per mettere a confronto una nuova dieta, contenente maggiori quantitativi di proteine totali, con una dieta contenente più carboidrati per le prevenzione dell’incidenza del T2D (45). Tuttavia, non è stato riscontrato alcun miglioramento significativo rispetto all’attuale dieta con più alto contenuto di carboidrati. Finora non sono stati riportati RCT a lungo termine sulle proteine del latte che indaghino sulla prevenzione dell’incidenza del T2D. Studi di intervento ci hanno fornito alcune informazioni sui potenziali meccanismi (46), evidenziando come le proteine del latte abbiano effetti più potenti sulla secrezione di insulina e di incretina rispetto ad altre proteine animali comunemente consumate (21). Gli effetti insulinotropi vengono associati sia alla composizione degli amminoacidi che al profilo del peptide bioattivo, laddove ad esempio l’inibizione della dipeptidil peptidasi-4 (DPP-4) aumenta i livelli di incretina, che a sua volta inibisce il rilascio di glucagone, aumenta la secrezione di insulina e diminuisce lo svuotamento gastrico (Figura 1). Insieme, questi a loro volta riducono le concentrazioni di glucosio nel sangue circolante. Il contenuto di aminoacidi viene determinato in gran parte dal maggior contributo apportato dalle proteine del siero di latte e dai conseguenti elevati livelli di aminoacidi a catena ramificata (BCAA) leucina, isoleucina e valina, oltre alla lisina (47). Studi clinici hanno riportato che gli AA del latte, tra cui leucina, isoleucina, glutammina, fenilalanina, prolina e lisina, hanno effetti positivi sull’omeostasi del glucosio. I BCAA stimolano la secrezione di insulina e di glucagone oltre a quella delle incretine GLP-1 (glucagon-like peptide-1) e GIP (gastric inhibitory peptide) (47). In termini pratici, tuttavia, non è ben stabilito se la dose di amminoacidi necessaria per ottenere queste risposte protettive possa essere prontamente raggiunta attraverso il consumo giornaliero raccomandato di latticini (48). Chiaramente, sono necessari studi più lungo termine che possano svelare la correlazione esistente tra proteine dei latticini, insulina e controllo del glucosio. In sintesi, non ci sono molti RCT che valutino gli effetti del consumo a lungo termine delle proteine dei latticini sull’incidenza di CVD o T2D. Vi sono tuttavia alcune conclusioni preliminari da trarre. Mentre mancano studi di coorte che mettano in relazione il siero di latte e la caseina con gli esiti CV e il T2D, gli RCT hanno individuato gli effetti benefici a medio termine delle proteine del siero di latte su fattori di rischio intermedi tra cui lipidi, lipoproteine, pressione sanguigna e parametri correlati al glucosio inclusa la secrezione di insulina. Studi postprandiali importanti forniscono prove del fatto che le proteine del siero di latte, e gli AA che le costituiscono, sono in grado di promuovere la secrezione di insulina come meccanismo di un migliore controllo glicemico. Poiché gran parte delle prove dei RCT, tuttavia, sono state ottenute da coorti in sovrappeso, non può essere esclusa la possibilità che la perdita di peso corporeo e di massa grassa possano contribuire ai miglioramenti della salute metabolica osservati in questi studi di intervento sui latticini.
Figura 1. Potenziale meccanismo di abbassamento del glucosio ad opera delle caseine e delle proteine del siero contenute nei latticini.
Grassi del latte
Il recente position paper del panel di esperti a cui si è fatto riferimento in precedenza riportava anche le prove a sostegno delle correlazioni esistenti tra acidi grassi del latte e salute metabolica. Il gruppo ha concluso che gli acidi grassi a catena media/trigliceridi (MCFA/MCT), i grassi a catena dispari, i SFA a catena molto lunga e l’acido palmitoleico trans erano associati ad una diminuzione del rischio di T2D e ad una migliore salute metabolica (18). Tuttavia, hanno sottolineato la possibilità che i risultati potessero essere confusi dagli acidi grassi del latte che agiscono come indicatori del consumo complessivo di latticini. Altre prove sono state presentate per quanto riguarda la membrana dei globuli di grasso del latte (MFGM), i fosfolipidi polari, l’acido vaccenico trans e l’acido linoleico coniugato (CLA) in relazione sia al rischio di T2D che di CVD, come riassunto di seguito.
Trigliceridi a media catena (MCT)
Gli MCT sono classificati come lipidi contenenti acidi grassi a media catena con 6-12 atomi di carbonio. Sono componenti minori delle diete globali, ma sono stati a lungo studiati come potenziali sostituti lipidici alimentari dei più abbondanti trigliceridi a lunga catena (LCT). Il latte è una fonte importante di MCT saturi, che costituiscono fino al 15% circa dei lipidi totali (22). Gli MCT subiscono una rapida idrolisi e assorbimento e contribuiscono all’eliminazione del lipedema, predisponendoli ad essere identificati come cardioprotettivi (49). Le prove rimangono tuttavia preliminari. Gli MCT subiscono una idrolisi quasi completa in acidi grassi liberi (FFA) e vengono assorbiti direttamente nella vena porta e quindi trasportati rapidamente al fegato per l’ossidazione. Ciò contrasta con quanto succede agli LCT , che vengono assorbiti più lentamente e trasportati dai chilomicroni nella circolazione sistemica prima dell’ossidazione o dello stoccaggio. Il concetto di ossidazione rapida che migliora i segnali di sazietà periferici e, a sua volta, promuove il controllo del peso corporeo è stato analizzato in diversi studi, ma con poche prove a supporto di studi sull’uomo (50). La prova di un miglioramento della salute metabolica proviene da diverse fonti. Studi in vitro sulle cellule muscolari scheletriche mostrano che gli MCT aumentano la capacità ossidativa mitocondriale e riducono l’accumulo di lipidi rispetto agli LCT, ma non attivano NF-κB o diminuiscono la sensibilità all’insulina (IS) (51, 52). Esistono prove preliminari anche da studi in vivo, che riportano un miglioramento dell’accumulo di grasso corporeo (53) e dell’insulino-resistenza negli animali alimentati con MCT rispetto a quelli alimentati con LCT saturi, che è in linea con questi studi precedenti. Nello studio DairyHealth, un intervento di 12 settimane con latte vaccino condotto in Europa, è stato dimostrato che gli MCT contenuti nei latticini inducono l’espressione genica dei pathway legati al metabolismo energetico in campioni di tessuto adiposo raccolti mediante biopsia da adulti con obesità addominale (54). Gli autori hanno anche mostrato una diminuzione protettiva dal punto di vista cardiometabolico dell’espressione genica associata all’infiammazione. Al contrario, nei modelli animali è stato dimostrato che gli MCT fanno aumentare la lipogenesi epatica de novo e l’accumulo di trigliceridi e fanno diminuire in senso negativo l’IS epatica, rispetto ad una dieta a basso contenuto di grassi (51, 53). Un miglioramento dello stoccaggio dei lipidi è stato segnalato anche in studi clinici condotti su adulti in sovrappeso, che includevano il consumo di burro ad elevato contenuto di MCT in combinazione con le proteine dei latticini (55). Lo studio DairyHealth, condotto su adulti affetti da obesità addominale, ha riportato anche un maggior consumo di MCT da latte al fine di aumentare la massa corporea magra e di diminuire la % di grasso corporeo totale in 12 settimane, nel contesto di una manipolazione della qualità del grasso isoenergetica (56).
Catena dispari
Gli acidi grassi a catena dispari (OCFA), acido pentadecanoico (C15:0) e acido eptadecanoico (C17: 0), sono SFA che si ritrovano nei latticini. Sono componenti minori che vanno a costituire ∼1.5% del grasso del latte, con C15:0 che è circa due volte più abbondante di C17:0. A lungo studiati come potenziali biomarker sierici indipendenti del consumo di latticini (57, 58), questi SFA con numero dispari di atomi di carbonio sembrerebbero venire sintetizzati solamente dalla flora batterica dei ruminanti (59, 60) senza precursori metabolici nell’uomo. Tuttavia, questo è stato messo in discussione dai dati emergenti sulla sintesi endogena e sul metabolismo di questi OCFA (61, 62). Più di recente si sono dimostrati utili i depositi di tessuto adiposo, anziché gli acidi grassi circolanti, con la prova che il C15: 0 del tessuto adiposo è in grado di rispecchiare sia il consumo abituale di latticini che i suoi cambiamenti (63). Per quanto riguarda la salute, recenti review hanno riportato che gli OCFA presenti nei latticini possono essere inversamente associati sia al rischio cardiometabolico (20) che al T2D (63) negli studi di coorte. C15:0 è stato proposto anche come acido grasso essenziale (64) con alcune prove (in modelli animali) di un miglioramento dell’infiammazione e della dislipidemia.
Membrana dei globuli di grasso (MFGM) e fosfolipidi polari
La MFGM è la membrana biologica che circonda le goccioline lipidiche che si ritrovano nel latte fluido. Questa e le componenti fosfolipidiche (PL) associate continuano ad essere collegate a benefici per la salute, inclusi quelli relativi alla salute metabolica, come recentemente rivisto da Anto et al. (65) in una review narrativa che presentava 11 RCT sugli effetti dei PL del latte sui lipidi sierici circolanti. In un crescente insieme di prove, vengono proposte ome coinvolte in problematiche diverse, tra cui il metabolismo lipidico dannoso (66 68), la resistenza all’insulina (69), l’infiammazione (70), la CVD mediante l’attenuazione dello sviluppo dell’aterosclerosi (65), la salute intestinale (71) e lo sviluppo neurologico. Strutturalmente la MFGM racchiude i globuli di grasso all’interno del latte. È composta da proteine, colesterolo e lipidi polari piuttosto che neutri, inclusi PL come la fosfatidilcolina (PC) e sfingolipidi come la sfingomielina (SM). Recenti analisi del latte vaccino con spettrometro di massa hanno confermato che la PC, la fosfatidiletanolamina (PE) e la SM sono le classi di lipidi polari più abbondanti (72). Il contenuto lipidico polare totale di un prodotto può variare notevolmente a seguito della lavorazione del latte, ma di solito costituisce solamente l’1% del contenuto lipidico totale. Eppure questi lipidi contribuiscono alle diverse caratteristiche di performance dei prodotti lattiero-caseari classici. La capacità di stabilizzare le emulsioni olio-acqua è una di queste, facendo si che i lipidi polari consentano l’emulsione del trigliceride neutro nella fase acquosa del latte liquido. Se consumati in quantità significative all’interno della dieta, i PL possono inibire l’assorbimento dei lipidi dal tratto GI, principalmente alterando la mobilizzazione dei lipidi dalle micelle sferiche che si formano in soluzione acquosa (73). La rottura della MFGM, ad esempio durante l’omogeneizzazione, verrà discussa più dettagliatamente nelle sezioni seguenti.
Acido vaccenico trans e acido palmitoleico trans
L’acido vaccenico trans-11 (C18: 1, t11) è un grasso trans monoinsaturo “naturale”, specifico dei prodotti lattiero-caseari e della carne che deriva dai ruminanti. Esistono alcune prove (74), sebbene non universali (75, 76), riguardanti il fatto che questi grassi non avrebbero quegli esiti negativi sulla salute cardiometabolica associati invece ad altre forme di grassi trans alimentari, a lungo sviluppati dall’industria alimentare attraverso l’idrogenazione industriale dei lipidi. Esistono numerose segnalazioni in vivo e in vitro degli effetti positivi dei grassi trans del latte sugli endpoint metabolici, tra cui l’aumento della secrezione di insulina, la crescita delle cellule β delle isole pancreatiche (77), la diminuzione dell’iperlipidemia (78) e l’accumulo ectopico di grasso epatico (79). Tuttavia, questi resoconti devono essere bilanciati con altri che invece non sostengono l’esistenza di un beneficio per la salute. Una review sistematica del 2010 di 39 studi clinici di intervento di Brouwer et al. (75) includeva 29 studi sui grassi trans industriali, 17 studi sul CLA e 6 studi sui grassi trans prodotti dai ruminanti. Hanno concluso che tutti gli acidi grassi aventi un doppio legame trans facevano aumentare il rapporto tra colesterolo LDL e HDL in senso negativo. Nel corso di un aggiornamento di questa review hanno notato l’evidenza contraddittoria riguardante il fatto che gli studi osservazionali non riescono a dimostrare un rischio più elevato di CVD associato ad un’elevata assunzione di grassi trans dei ruminanti, nonostante la conferma dell’esistenza di effetti negativi sul profilo lipidico nel sangue circolante (80). Al contrario, si stanno raccogliendo prove di esiti positivi per il T2D, dove risulta di particolare interesse l’acido palmitoleico trans monoinsaturo (16: 1, t9). In recenti pubblicazioni è stato associato ad una minore incidenza di T2D (18, 81) e di malattia coronarica (CAD) (81), è può essere assunto sia tramite il consumo di latticini sia fornito dalla conversione endogena dal suo precursore metabolico acido vaccenico trans (82) . La prova di un effetto protettivo dell’acido palmitoleico trans del latte proviene da una recente ampia meta-analisi di 16 studi prospettici di coorte comprendenti più di 60.000 partecipanti. Condotta dal consorzio di ricerca sugli acidi grassi e sui risultati (FORCE), questa analisi ha mostrato l’esistenza di un’associazione significativa tra l’acido palmitoleico trans e la diminuzione del rischio di T2D (58). Tuttavia, è necessario aggiungere una nota di cautela, con diversi autori che mettono in dubbio la natura efficace dei metodi utilizzati per l’analisi degli esteri metilici degli acidi grassi (FAME) del latte bovino, citando la difficoltà nella separazione completa e nell’identificazione inequivocabile dei FAME all’interno della composizione lipidica molto complessa del latte dei ruminanti (83, 84). I vari percorsi che collegano questi grassi trans al CLA sono ora ben compresi, inclusa la desaturazione dell’acido vaccenico trans-11 (18: 1) da parte dell’enzima 19-desaturasi all’interno della ghiandola mammaria per formare CLA cis-9, trans-11 (18 : 2) (Figura 2). Ciò si aggiunge alla formazione del CLA tramite bioidrogenazione dell’acido linoleico (18:2) all’interno del rumine bovino e alla successiva sintesi di acido vaccenico trans. È stato proposto che la sintesi tramite 19-desaturasi sia la fonte primaria di CLA cis-9, trans-11 presente nel grasso del latte bovino (85).
Figura 2. Cis-9, trans-11 CLA (18:2) viene generato sia dall’idrogenazione dell’acido linoleico (18:2) nel rumine sia dalla desaturazione dell’acido vaccenico trans-11 (18:1) nella ghiandola mammaria.
Acido linoleico coniugato (CLA)
Il CLA è un acido grasso polinsaturo (PUFA) con doppi legami coniugati presenti in entrambe le forme cis e trans, il cui isomero più comune è l’acido linoleico cis-9 trans-11. Nonostante si trovi nei latticini e nelle carni dei ruminanti, e in quantità minori negli oli vegetali e nei frutti di mare, il CLA viene ampiamente prodotto anche a livello industriale per essere venduto come integratore. Proprio come per l’acido vaccenico, esistono segnalazioni di benefici per la salute cardiometabolica (86, 87). Una review sistematica e una meta-analisi di 33 RCT che studiavano l’effetto del CLA dei ruminanti (in forma di integratore o proveniente da alimenti arricchiti) sul profilo lipidico in popolazioni adulte sane, hanno riportato che entrambi i formati riducevano significativamente il colesterolo LDL con effetti minori e non significativi su altri lipidi (87). La review, tuttavia, ha evidenziato anche l’esistenza di preoccupazioni sulla potenziale sicurezza del CLA, con segnalazioni di un aumento dell’insulino-resistenza e di lipodistrofia in modelli animali, oltre ad alcune risposte avverse ai lipidi e al C-RP negli studi clinici. In linea con questa nota di cautela, diverse review recenti hanno concluso che molti dei risultati positivi riportati dagli studi condotti su modelli animali o in vitro non sono stati adeguatamente replicati negli studi clinici (88, 89). La review del 2018 di Li et al. ha segnalato la mancanza di dati clinici per gli endpoint critici CV. Hanno individuato soltanto 1 studio osservazionale caso-controllo che mostrava una relazione inversa tra i livelli di CLA cis-9, trans-11 nel tessuto adiposo e il rischio di infarto (90), e 3 RCT che non mostravano alcun effetto significativo del CLA su lipidi del sangue, glucosio, CRP, pressione sanguigna, resistenza all’insulina, composizione corporea o sul rischio assoluto a 10 anni di CVD fatale nei pazienti obesi (91). È stata segnalata una mancanza di efficacia simile in coorti sane (92) e in pazienti con aterosclerosi (93). Ci sono prove di un miglioramento dei livelli di C-RP da uno studio di intervento in pazienti con CVD in atto (94). Per contro esistono prove, come per l’acido vaccinico, del fatto che il CLA influisca negativamente sul profilo delle lipoproteine, con un aumento del colesterolo LDL circolante e del rapporto colesterolo totale: HDL fornite da una review esaustiva di 48 studi sul CLA e di 11 RCT sui grassi trans dei ruminanti (80). Inoltre, in una review sistematica pubblicata di recente, è stato evidenziato un peggioramento dei fattori di rischio associati a CVD, incluse la proteina di fase acuta C-RP [Haghighatdoost e Nobakht-M-Gh 2018, (95)] e la citochina TNF-α (96). Una meta-analisi del 2017 di 32 RCT su alimenti arricchiti ed integratori di CLA non ha mostrato alcun effetto significativo sul glucosio a digiuno (88). Una recente review narrativa ha rilevato la mancanza di unanimità nell’interpretazione degli effetti del CLA sulla perdita di peso corporeo e sull’obesità, a causa della piccola dimensione del campione, della dose variabile, della variabilità degli isomeri del CLA, delle durate di intervento e delle caratteristiche di popolazione (97); ma va detto che gli effetti benefici dovuti all’integrazione sui parametri relativi al peso corporeo e/o all’adiposità sono stati riportati in una serie di studi, senza evidenza di conseguenze metaboliche negative. Anche questa review riporta una simile assenza di unanimità per gli endpoint glicemici, sia con effetti positivi sul metabolismo del glucosio sia con nessun beneficio clinico riportato negli RCT (97). In sintesi, non ci sono RCT che valutino gli effetti a lungo termine di queste componenti lipidiche specifiche del latte sull’incidenza di CVD o di T2D. Pochissime prove supportano i MCT come cardioprotettivi, con risultati clinici preliminari che riportano soltanto dei modesti miglioramenti nella composizione corporea. Anche gli OCFA sono stati associati ad una diminuzione del rischio di CV e T2D negli studi di coorte, ma non sono disponibili dati di intervento. Inoltre, abbiamo poche prove del fatto che la MFGM e le componenti PL associate dei latticini possano migliorare gli endpoint intermedi di CV e T2D, in RCT di durata compresa tra un giorno e le 12 settimane che riportino come esiti il metabolismo lipidico, la risposta infiammatoria e la resistenza all’insulina. Le prove a sostegno dei grassi trans sono più complesse e controverse. L’acido vaccenico trans dei ruminanti (trans-VA) potrebbe non generare la risposta avversa ben dimostrata negli endpoint di rischio CV dei grassi trans di derivazione industriale. Vi è tuttavia una mancanza di unanimità nelle prove, con gli effetti neutri del trans-VA osservati in studi di coorte non supportati da prove RCT, dove la review sistematica ha concluso che tutti gli acidi grassi contenenti un doppio legame trans aumenterebbero negativamente i profili delle lipoproteine, indipendentemente dalla loro origine. Al contrario, sono stati riportati esiti positivi per il rischio di T2D per quanto riguarda l’acido palmitoleico trans (trans-PA), anche questo presente in quantità minori nei latticini, e studi di coorte lo hanno correlato ad una diminuzione del rischio di T2D. Anche il CLA è stato proposto come cardio protettivo, sia dopo il consumo di prodotti di origine animale (ruminanti) sia in seguito all’integrazione con prodotti di origine industriale presenti nella dieta occidentale, ma con livelli di prove pubblicate molto variabili. Si passa dalle meta-analisi di RCT, che mostrano sia un miglioramento significativo che un peggioramento significativo nei fattori di rischio delle lipoproteine, a nessun effetto significativo su FPG, fino a dati molto limitati che sostengono l’associazione con un aumento dell’incidenza CV negli studi osservazionali. Attualmente non c’è unanimità sui risultati, probabilmente a causa di fattori come l’elevata variabilità degli isomeri e la dose di CLA assunta, la dimensione e la tipologia delle coorti sperimentali reclutate e la durata dei RCT.
Micronutrienti: Vitamina D, Calcio
Le correlazioni tra vitamina D, calcio e vari aspetti della salute cardiometabolica sono state a lungo dibattute. In questa review, l’attenzione è stata posta sulle prove alla base delle relazioni tra vitamina D e T2D, calcio e CVD. I latticini contengono naturalmente poca vitamina D, ma sono una categoria alimentare molto dibattuta quando si parla di alimenti arricchiti. Il latte fluido, e la miriade di prodotti derivati da esso, storicamente sono stati arricchiti (obbligatoriamente o facoltativamente) con vitamina D da parte dell’industria alimentare. Una recente review ha riportato che attualmente i prodotti lattiero-caseari vengono sistematicamente fortificati con vitamina D solamente nei paesi del Nord Europa come Finlandia, Norvegia, Svezia e negli stati del Canada e del nord degli Stati Uniti (98). Per un certo numero di anni abbiamo raccolto prove da studi osservazionali contrastanti, che collegavano bassi livelli di 25-idrossivitamina D (25 (OH) D) al T2D e che hanno portato ad interventi di sostituzione della vitamina D condotti con l’intento sia di migliorare il controllo glicemico che di diminuire l’incidenza di T2D (99). O sintetizzata nella pelle, in risposta all’esposizione alla luce solare, e/o assunta con la dieta e come integratore, la 25 (OH) D è la principale forma circolante di vitamina D. È stata collegata ad alterazioni della glicemia e al T2D tramite meccanismi che influenzano sia l’insulino-resistenza che la secrezione di insulina da parte delle cellule β pancreatiche, nonché dall’infiammazione e dall’accumulo di prodotti finali della glicazione avanzata (AGE) (Figura 3).
Figura 3. La vitamina D è legata all’alterazione della glicemia e al T2D tramite meccanismi che influiscono sia sulla secrezione di insulina da parte delle cellule β pancreatiche sia sull’insulino-resistenza, così come dal’infiammazione sistemica.
Una serie di prime review sistematiche e meta-analisi hanno supportato l’esistenza di una relazione inversa protettiva tra vitamina D e T2D. Un’analisi di 8 studi osservazionali di coorte ha riportato che un elevato livello di vitamina D (> 25 ng/ml) era associato quasi ad un dimezzamento del rischio di T2D rispetto ad un livello più basso (100). Un’altra review più recente di 21 studi di coorte ha mostrato un simile rischio relativo di 0.62, e utilizzando l’analisi del trend lineare ha riportato anche che per ogni incremento di 10 nmol/L dei livelli circolanti di 25 (OH) D c’era una diminuzione del 4% del rischio associato di T2D (101). Anche un’altra meta-analisi di 16 studi di coorte ha evidenziato un effetto positivo (102). L’adiposità e la massa grassa sono fattori confondenti nel rapporto tra vitamina D e T2D. La vitamina D viene sequestrata dal tessuto adiposo quindi una massa grassa elevata agisce come un “serbatoio” per la vitamina D, di conseguenza la maggiore quantità di vitamina D necessaria per saturare i grandi depositi degli individui obesi predispone a bassi livelli di 25 (OH ) D circolante (103). A sua volta l’obesità stessa è stata a lungo identificata come un fattore predisponente molto influente per il T2D (104). Sono stati condotti molti meno studi clinici di intervento, che comprendevano fattori di confondimento tra cui il mancato raggiungimento di sufficienti livelli circolanti di vitamina D (105). I livelli circolanti richiesti di 25 (OH) D necessari per attuare un controllo glicemico e per ridurre il rischio di sviluppare T2D non sono stati ancora determinati. Si ipotizza che questi possano essere superiori a quelli richiesti per una salute ossea ottimale (99). Le conclusioni sono notevolmente variate da quelle delle meta-analisi che riportavano esiti cardiometabolici positivi, inclusi i risultati di un’analisi di 9 RCT che mostravano come lo yogurt fortificato con vitamina D diminuisse l’HOMA-IR, il glucosio sierico a digiuno e il colesterolo totale nei pazienti normoglicemici e con T2D (106), e i risultati dell’analisi di 19 RCT che mostravano miglioramenti sia nell’IR che nell’HbA1c in pazienti con T2D (107). Al contrario, review sistematiche condotte in precedenza non riportavano alcun effetto dell’integrazione con vitamina D sugli esiti glicemici in una meta-analisi di 11 (100) e 15 RCT di pazienti normoglicemici e con T2D. Quest’ultimo, tuttavia, mostrava che l’analisi di una sotto-coorte di pazienti con T2D o IGT aveva prodotto un piccolo effetto sulla glicemia a digiuno e sull’IR, ma non sull’HbA1c (108). Il calcio e la salute metabolica sono stati oggetto di un esame approfondito negli ultimi anni. Nel complesso, il calcio non contribuisce in modo convincente ai benefici cardiometabolici dei latticini che possono essere osservati. Comunemente utilizzato come supplemento per promuovere la salute delle ossa come contributo alla prevenzione del rischio di frattura negli anziani, le meta-analisi di RCT a lungo termine hanno individuato, inaspettatamente, che l’integrazione di calcio sarebbe capace di provocare un moderato aumento del rischio di infarto (109, 110). Il meccanismo alla base di questo rischio potrebbe essere l’ipercalcemia postprandiale, che a sua volta contribuisce alla calcificazione vascolare. È interessante notare che i polimorfismi a singolo nucleotide (SNP) correlati ai livelli sierici di calcio più elevati, più di recente sono stati associati ad un aumento del rischio di malattia coronarica e di infarto del miocardio in studi sul genoma (111). È chiara, tuttavia, l’importanza di differenziare l’origine del calcio assunto, poiché esistono effetti diversi tra il calcio consumato come integratore alimentare e il calcio assunto da latticini. È stato proposto che gli integratori di calcio, ma non il calcio contenuto nei prodotti alimentari, possano avere un rapporto rischio-beneficio negativo, tanto che l’utilizzo di routine per la prevenzione o il trattamento dell’osteoporosi non viene più universalmente raccomandato (112). In effetti, le prove attuali non supportano più l’integrazione routinaria di calcio o vitamina D per la salute delle ossa negli adulti sani residenti all’interno della comunità, in gran parte sulla base degli esiti avversi sulla CVD (113). Anche le prove a sostegno del calcio derivato dai latticini per la prevenzione del T2D sono contrastanti, sebbene, come recentemente rivisto (22), ci siano molteplici meccanismi attraverso i quali il calcio può influenzare i fattori di rischio del T2D. Ciò include la regolazione dei processi intracellulari mediati dall’insulina in tessuti specifici che rispondono a questo peptide, il contributo alla funzione secretoria delle cellule β del pancreas e la fosforilazione dei recettori dell’insulina. Il calcio si è anche dimostrato capace di abbassare la regolazione dei geni che codificano per le citochine pro-infiammatorie coinvolte nell’IR. Nella loro review Mozaffarian et al. hanno riportato anche > 20 studi osservazionali sulle associazioni tra assunzione di calcio e prevenzione del T2D (22), e 3 ampi studi di coorte condotti negli Stati Uniti e in Cina hanno mostrato l’esistenza di un’associazione inversa tra un’elevata assunzione di calcio e un basso rischio di T2D in sotto-coorti di donne ma non di uomini. Anche un quarto ampio studio di coorte condotto in Giappone ha osservato l’esistenza di questa relazione inversa, ma solo in sotto-coorti con vitamina D sierica più elevata. Gli altri studi più piccoli hanno riportato risultati contrastanti, senza una chiara unanimità. Oltre a questa review, il Korean Genome and Epidemiology study [KoGES (114)], uno studio prospettico di coorte con follow-up di 10 anni condotto su > 10.000 adulti di una coorte asiatica, ha riportato come esito positivo che un maggior apporto di calcio dietetico, ma non il calcio sierico, era associato ad un minor rischio di sviluppare T2D.
Lavorazioni: fermentazione, probiotici e omogenizzazione
Esistono numerose prove sul fatto che i metodi di lavorazione, tra cui la fermentazione, l’aggiunta di batteri e di lieviti probiotici e l’omogeneizzazione, possono tutti influenzare la salute cardiometabolica, come presentato nelle sezioni seguenti.
Fermentazione
Sia il formaggio (“stagionato”) che lo yogurt sono prodotti lattiero-caseari fermentati comunemente consumati. Il processo di fermentazione richiede l’inoculo di una coltura starter, che può variare notevolmente per ottenere la consistenza, il sapore e il profilo di sicurezza desiderati. I batteri lattici sono i principali batteri utilizzati nel processo di fermentazione dei prodotti alimentari moderni e possono includere i generi Lactobacillus, Lactococcus, Streptococcus, Leuconostoc, Pediococcus ed Enterococcus, ma anche lieviti e muffe possono essere utilizzati nella produzione di formaggio (115). Il tasso di acidificazione tramite la produzione di acido lattico insieme alla secrezione di metaboliti secondari, tra cui batteriocine, ammine biogene, esopolisaccaridi e peptidi rilasciati proteoliticamente, sono aspetti chiave del processo di fermentazione. Nello specifico, né il formaggio né lo yogurt esercitano gli effetti negativi sui lipidi nel sangue che sarebbero previsti unicamente dal contenuto e dalla composizione dei loro SFA (116, 117). Il consumo di yogurt è chiaramente associato ad una diminuzione del rischio sia di T2D che di malattie cardiometaboliche, come esaminato dal recente panel di esperti di Guo et al. (18). Sebbene una serie di fattori possano essere coinvolti, i processi di fermentazione, il contenuto e la composizione dei probiotici sono stati entrambi proposti come aspetti significativi.
Probiotici
I batteri probiotici sono componenti comuni degli alimenti fermentati, tra cui i latticini, gli yogurt da bere e il kefir (una bevanda a base di latte fermentato). Il kefir, simile a uno yogurt liquido da bere, è un prodotto introdotto più di recente nella dieta occidentale, e viene preparato attraverso l’inoculazione nel latte di ruminante dei “grani” di kefir, costituiti sia da batteri che da lieviti. Più generi di probiotici sono stati valutati in studi di coorte e RCT, e i due più comunemente utilizzati sono Lactobacillus e Bifidobacterium. Da tempo i probiotici vengono proposti come aventi effetti positivi sulla salute, effetti ottenuti attraverso alterazioni sia della composizione che della funzione del microbioma dell’intestino crasso dell’ospite, ed esiste una vasta letteratura che indaga sugli esiti della salute metabolica correlati all’obesità (118). I meccanismi proposti includono una migliore integrità dell’epitelio intestinale, una riduzione della risposta infiammatoria indotta da endotossiemia di basso grado e la promozione degli acidi grassi a catena corta del colon (SCFA), incluso il butirrato, come fonte di nutrienti per i batteri dell’intestino crasso (119, 120). È stato visto che gli effetti probiotici dello yogurt possono modulare la glicemia e gli endpoint correlati, e quindi esercitare effetti benefici (117), ma mancano le prove per stabilire il contrario. Astrup ha valutato sia gli studi di coorte che i RCT, concludendo che i dati osservazionali sostengono l’esistenza di un’associazione significativa tra yogurt, diminuzione del rischio di aumento di peso corporeo e CVD, ma nello specifico questa evidenza è stata supportata solamente in parte dai RCT. Anche una successiva review del 2017 che riportava 7 RCT, oltre alle prove su modelli animali, a sua volta ha concluso che gli effetti dei probiotici sul controllo glicemico apparivano discordanti (121). Una review narrativa del 2016 (122) di RCT su probiotici, prebiotici e su una combinazione essi ha concluso che i probiotici hanno solamente un piccolo effetto (∼3%) sugli endpoint metabolici, con risultati massimizzati se consumati all’interno di latti fermentati o di yogurt per un periodo prolungato di almeno 8 settimane. Una domanda importante è se esista una relazione causale indipendente tra i probiotici di per sé e i miglioramenti nella CVD, nel T2D o in altri esiti riguardanti la salute metabolica, indipendentemente da una matrice alimentare come lo yogurt. In particolare, una recente review sistematica e meta-analisi di RCT hanno valutato gli effetti dello yogurt probiotico, rispetto ad uno yogurt di controllo, sugli esiti glicemici in individui obesi e in quelli con T2D, e non hanno riportato ulteriori benefici dello yogurt probiotico (123). Una review sistematica completa e una meta-analisi di 20 studi prospettici di coorte e di 52 RCT (124) ha messo in evidenza gli effetti positivi di latti fermentati, yogurt e probiotici. La review riportava che il consumo di latte fermentato era associato ad una diminuzione del rischio di CV, con l’aggiunta di probiotici nelle matrici dei latticini che abbassavano il profilo lipidico sierico, mentre il consumo di yogurt era associato ad una diminuzione del T2D e del rischio di sindrome metabolica. Gli autori hanno tuttavia notato che l’eterogeneità di questi studi multipli, inclusa la variabilità dei ceppi probiotici, farebbe si che risultati debbano essere interpretati con cautela.
Omogenizzazione
Il latte vaccino viene comunemente omogeneizzato per aumentare la stabilità fisica del prodotto alimentare. Aiuta a prevenire la separazione dell’acqua dalle componenti lipidiche in doppi strati, grazie alla diminuzione delle dimensioni delle goccioline lipidiche e all’incorporazione delle proteine del latte nell’interfaccia delle goccioline. È stato proposto che la diminuzione delle dimensioni dei globuli di grasso del latte, essenzialmente una rottura della MFGM, consentirebbe loro di disperdersi uniformemente all’interno del latticino, e si tradurrebbe in una migliore digeribilità e in potenziali esiti per la salute (125). Nella loro recente review, Mozaffarian et al. (22) hanno notato che l’omogeneizzazione può distruggere la MFGM ed hanno proposto che ciò potrebbe avere implicazioni sugli effetti cardiometabolici dei lipidi da latte. Hanno citato un RCT di 8 settimane che metteva a confronto la panna da montare (MFGM intatta) con l’energia, i latticini totali e i SFA attribuiti ai grassi del burro (MFGM omogeneizzata, ridotta) (67). Il grasso del burro ha peggiorato sia il rapporto LDL-C che quello apolipoproteina B:A-I, mentre non sono stati individuati effetti durante l’intervento con la panna da montare.
I latticini e la controversia sui grassi saturi
L’elevato contenuto di acidi grassi saturi (SFA) dei latticini e della miriade di prodotti derivati da essi ha destato a lungo preoccupazione (126), in linea con le linee guida internazionali (126, 127) che miravano a ridurre al minimo l’assunzione dietetica di SFA di origine animale al fine di ottenere una migliore salute cardiometabolica. Le prime review sistematiche supportavano l’esistenza di una correlazione tra acidi grassi alimentari e lipidi sierici, e anche tra lipidi sierici e morbilità e mortalità CV, come recentemente riassunto da Hooper et al. (128). I meccanismi mediante i quali i SFA di origine animale possono influire negativamente sui lipidi circolanti includono l’inibizione della rimozione del recettore LDL delle lipoproteine dalla circolazione, l’aumento della secrezione di ApoB100 contenente lipoproteine VLDL e LDL nella circolazione e lo stoccaggio del colesterolo in eccesso nelle particelle LDL; quindi in combinazione aumenterebbero le concentrazioni circolanti di LDL-C, TC e del rapporto LDL-C:HDL-C. Nella loro review sistematica Cochrane questi autori a loro volta hanno dimostrato che una diminuzione prolungata (2 anni +) del consumo alimentare di SFA sarebbe associata ad una significativa diminuzione degli eventi CV combinati, con qualche prova di un rapporto legato alla dose (128). La sostituzione dei SFA con i PUFA (ma forse non con i MUFA) e/o con i carboidrati sarebbe stato proposto come l’approccio di maggior successo. Tuttavia, negli ultimi 10 anni si è creato un insieme di studi che hanno messo in dubbio la presenza di effetti negativi legati all’assunzione di SFA derivanti dai latticini, sia per quanto concerne gli esiti CV che per quelli di T2D. In particolare, non è più corretto considerare i nutrienti in modo isolato, poiché esiste l’evidenza che la matrice complessa di un alimento può essere ugualmente o più importante del contenuto e della composizione dei soli acidi grassi quando dobbiamo prevedere il rischio cardiometabolico (3, 10, 11). È stato proposto che quando si parla di un latticino complesso come il formaggio, ad esempio, l’effetto dei SFA sui lipidi nel sangue e sul rischio di malattie può essere controbilanciato dal contenuto di proteine, di calcio o di altre componenti della dieta (23, 129). Oltre a ciò va detto che esistono sempre più prove a sostegno del fatto che l’aumento del colesterolo LDL indotto dai SFA della dieta potrebbe, di per sé, non influire negativamente sulla salute cardiometabolica (3). Le prove che sono alla base della relazione tra il grasso dei latticini e gli esiti cardiometabolici fino ad oggi provengono principalmente da studi osservazionali. Questo deve essere tenuto in considerazione poiché gli studi di associazione non possono determinare le relazioni di causa ed effetto, e sono soggetti a fattori confondenti che possono influenzare le correlazioni tra dieta ed esiti della malattia. I trial clinici condotti sull’uomo che studiavano gli interventi con i latticini solitamente erano di breve o modesta durata, con endpoint di rischio intermedio di CV o T2D e non con l’incidenza della malattia. Di seguito presentiamo un riepilogo di entrambi.
Studi osservazionali
CVD: In contrasto con le precedenti preoccupazioni riguardanti i gruppi di alimenti di origine animale ad elevato contenuto di SFA (1), non ci sono prove concordanti da studi epidemiologici sul fatto che un consumo maggiore di latticini sia associato ad un aumento del rischio di CVD o dell’incidenza di CVD (3, 4, 6, 7, 20, 130 ). Nella Tabella 1a sono riassunte le più importanti review sistematiche, le meta-analisi, le review generali e le review narrative. Nel 2014 Astrup ha riassunto gli studi osservazionali che riportavano come il consumo di latte o di latticini fosse in effetti inversamente correlato all’incidenza di CVD (117), un risultato supportato da una recente review all’avanguardia (3). L’inserimento di latticini nella dieta può migliorare aspetti di una scarsa salute metabolica tra cui dislipidemia, insulino-resistenza, ipertensione, obesità addominale e sindrome metabolica (137), che insieme aumentano notevolmente il rischio sia di T2D che di CVD. Ciò era stato evidenziato in precedenza da meta-analisi di studi prospettici di coorte che identificavano l’esistenza di un’associazione inversa tra il latte e altre tipologie di latticini e gli endpoint CV (4, 5, 116), con Elwood et al. che originariamente hanno evidenziato una discrepanza tra queste prove e le percezioni del danno derivante dal consumo di latticini (4). Nel 2015 una meta-analisi di studi prospettici di coorte ha fornito ulteriori prove a sostegno dell’effetto benefico sulla CVD derivante dal consumo di latticini. I latticini e i formaggi a basso contenuto di grassi possono proteggere dall’ictus o dall’incidenza di malattia coronarica (6), soprattutto lo yogurt (134). Una meta-analisi del 2016 di studi prospettici di coorte ha dimostrato ancora una volta che il consumo di latticini può essere associato ad una diminuzione del rischio di CVD, sebbene gli autori abbiano fatto notare la necessità di dati aggiuntivi per esaminare in modo più completo i potenziali modelli dose-risposta (7). È ora evidente che la maggior parte delle meta-analisi non riporta alcuna associazione o almeno una debole associazione inversa tra il consumo di latticini e gli endpoint di CVD (8, 20, 131, 133, 135, 136) o i biomarker di rischio, tra cui il colesterolo LDL delle lipoproteine sieriche. Individuata come una papabile prova convincente, una recente review generale del 2020 di Godos et al., ha riportato una diminuzione dell’associazione tra consumo di latticini totali e la CVD (9). Probabilmente ci sono più controversie quando si parla di studi sui grassi del burro (2, 132). Anche il recente studio multinazionale Prospective Urban Rural Epidemiology (PURE) condotto da 21 paesi nei cinque continenti, ha riportato risultati simili, con il consumo di latticini associato ad un minor rischio di mortalità e di gravi eventi cardiovascolari (130). Tuttavia, anche alla luce di un’assenza di una associazione negativa tra latticini e CVD, vi sono alcune prove secondo le quali la sostituzione del grasso del latte con i PUFA, provenienti soprattutto da alimenti di origine vegetale, potrebbe essere vantaggiosa ed apportare benefici per la salute (20).
T2D: Mentre studi prospettici di coorte solitamente mostravano che una gamma di prodotti di origine animale, ad esempio carni rosse e lavorate, era associata ad un aumento del rischio di T2D (138), numerose meta-analisi e review sistematiche hanno riportato che il consumo di latticini potrebbe avere un effetto neutro o anche di diminuzione sul rischio di T2D (vedere tabella 1b). Queste review utilizzano dati provenienti da popolazioni adulte a livello globale, e riportano i maggiori effetti in seguito all’utilizzo di yogurt e formaggio (19), a loro volta rappresentativi, rispettivamente, dei latticini a basso contenuto di grassi e di quelli ad elevato contenuto di grassi.
Tabella 1a Riassunto delle meta-analisi, delle review sistematiche e delle review narrative che riportavano esiti di CVD: studi osservazionali.
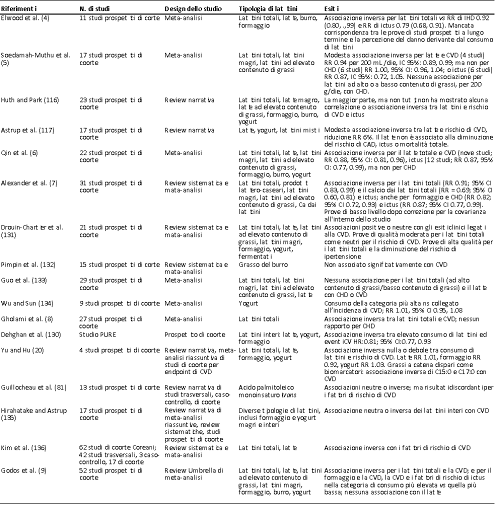
CAD, patologia coronarica arteriosa; CHD, patologia coronarica cardiaca; CI, intervallo di confidenza; CVD, patologia cardiovascolare; HR, hazard ratio; IHD, patologia cardiaca ischemica; RR, rischio relativo.
La prima meta-analisi di studi osservazionali di coorte ha mostrato che anche un numero maggiore di latticini totali è associato ad una riduzione del rischio di T2D (4), così come ha mostrato un’altra piccola meta-analisi di 7 studi di coorte (12). Nel 2013 Aune et al. hanno pubblicato una meta-analisi di 17 studi prospettici di coorte, riportando che un maggiore consumo di latticini e formaggi totali, nonché di latticini a basso contenuto di grassi, era associato a un minor rischio di T2D (13). Inoltre, lo studio della dose-risposta ha mostrato una diminuzione del 7% del rischio di T2D per ogni 400 g di latticini consumati al giorno, che è stato stimato essere equivalente a ∼1.7 porzioni di latte fluido al giorno (13). Una seconda meta-analisi di 14 studi prospettici di coorte ha confermato una simile diminuzione del 6% del rischio di T2D per ogni 200 g di latticini totali consumati al giorno, insieme ad una diminuzione del 12% per ogni 200 g di latticini a basso contenuto di grassi consumati al giorno (14). Questo è aumentato ulteriormente fino a raggiungere un rischio di T2D inferiore al 20% per ogni 30 g di formaggio e un rischio inferiore al 9% associato al consumo di 50 g al giorno di yogurt fermentato, cosa che ci dimostra l’esistenza di un’associazione inversa tra consumo di latticini e rischio di T2D. La meta-analisi di Gijsbers et al., ha anche riportato un’associazione inversa tra il consumo di latticini e il rischio di T2D (16), così come hanno affermato anche Schwingshackl et al. (139) e Soedamah-Muthu et al. (140). Una recente meta-analisi aggiornata del 2019 di 12 studi ha riportato che il consumo di latticini totali è associato ad un minor rischio di T2D, con effetti moderati del formaggio e con effetti più marcati di yogurt e latticini a basso contenuto di grassi (17), dati supportati anche da una review del 2020 di 12 studi prospettici di coorte (9). Tuttavia, in particolare durante un’analisi combinata di uomini e donne dell’US Health Professionals Follow-up Study e dell’US Nurses’ Health Study I and II, non è stata osservata alcuna correlazione con i latticini totali, i latticini a basso o ad elevato contenuto di grassi, e con il solo consumo di yogurt associato ad una diminuzione del rischio di T2D (15). Questo appariva in contrasto con i risultati precedenti di un’associazione significativa con i latticini totali provenienti da queste grandi coorti degli Stati Uniti. Gli autori hanno ipotizzato che il follow-up più lungo (+10 anni) potrebbe spiegare questo cambiamento nei risultati, come a sua volta osservato in una meta-analisi di precedenti studi di coorte pubblicati dal loro gruppo di ricerca, nei quali i benefici del consumo di latticini erano diminuiti in studi con follow-up a lungo termine (15). Pimpin et al. hanno riportato un’associazione inversa con l’incidenza di T2D nella loro più recente meta-analisi riguardante il grasso del burro (132). Altri grandi studi prospettici di coorte condotti negli Stati Uniti supportano l’esistenza di una correlazione neutra, non negativa, tra i latticini totali e il rischio di T2D, compreso lo studio osservazionale della Women’s Health Initiative condotto su donne in postmenopausa. Sebbene un maggior consumo di latticini fosse associato ad una diminuzione del rischio del 40-50%, è stato visto come questi grandi effetti fossero correlati al consumo di latticini e yogurt a basso contenuto di grassi (141). Anche studi prospettici di coorte condotti al di fuori degli Stati Uniti (in Gran Bretagna, Europa, Giappone e Australia) hanno evidenziato gli effetti benefici, o neutri, derivanti dal consumo di latticini totali, nonché di gruppi specifici di latticini (che includevano latticini e formaggi ad alto contenuto di grassi oltre a latticini a basso contenuto di grassi o yogurt) sul rischio di T2D (142-149). Ciò è stato confermato in un recente position paper di un panel di esperti (18), tuttavia resta importante notare che la possibilità di confondimento è un aspetto degli studi osservazionali che richiede la loro revisione unitamente a RCT ben progettati e condotti al fine di ottenere un consenso uniforme. Nel complesso, esiste un ampio corpo di dati provenienti da ampi studi osservazionali di lunga durata, raccolti negli ultimi +20 anni, che supportano l’associazione tra il consumo di latticini totali e la diminuzione dell’incidenza di CVD e/o di T2D. Le meta-analisi di studi prospettici di coorte sull’incidenza correlata a CVD supporta la recente caratterizzazione di questa evidenza come “convincente e probabile”. Sebbene non sia ancora chiaro quali siano i modelli dose-risposta per i latticini e la CVD, esistono forti associazioni che suggeriscono differenti correlazioni con le diverse tipologie di latticini, in particolare latte liquido, burro, formaggio e yogurt. Osservazioni simili sono state riportate per l’incidenza del T2D. Come sottolineato sopra, se le prove sono ottenute esclusivamente da dati osservazionali si può creare confusione. Abbiamo a nostra disposizione molti meno dati da studi d’intervento sull’uomo, dai quali si potrebbe costruire un’intesa sulle correlazioni tra CVD o T2D e i latticini totali o i gruppi di latticini come latte, formaggio, burro e yogurt. In particolare vi è una mancanza di RCT sui latticini progettati per valutare endpoint di CVD ed eventi di T2D, necessari per concludere che la totalità delle prove sia convincente.
Tabella 1b Riassunto delle meta-analisi, delle review sistematiche e delle review narrative che riportavano esiti di T2D: studi osservazionali.
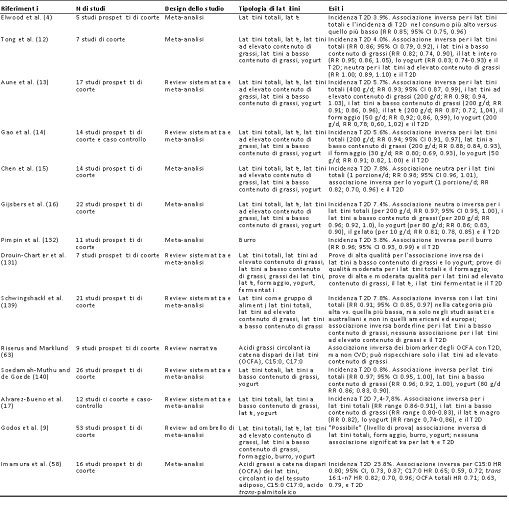
CI, intervallo di confidenza; HR, Hazard Ratio; IHD, patologia cardiaca ischemica; OCFA, acidi grassi a catena dispari; RR, rischio relativo; T2D, diabete tipo 2.
TRIAL CONTROLLATI RANDOMIZZATI (RCT)
CVD: Ci sono molti meno dati disponibili dai RCT sui quali si potrebbe basare il consenso relativo alle correlazioni tra CVD, latticini totali o tipologie di latticini come formaggio, burro e yogurt (vedere Tabella 1c). Huth e Park (116) riferirono originariamente su studi di intervento a breve termine sui biomarker lipidici, secondo i quali diete con un contenuto maggiore di SFA da latte intero e da burro avevano effetti negativi sull’aumento del colesterolo LDL quando venivano sostituiti da carboidrati o USFA. Gli effetti avversi di un elevato contenuto di SFA, rispetto agli effetti di un elevato contenuto USFA (PUFA + MUFA) nel grasso del burro, sui parametri lipidici di uomini magri e sani sono stati precedentemente segnalati dal nostro laboratorio (150, 151). La meta-analisi (116), tuttavia, ha mostrato anche un aumento del C-HDL cardio-protettivo, con conseguente peggioramento minimo o nullo del marker chiave di CVD rappresentato dal rapporto colesterolo totale:HDL-C. Inoltre, è stato dimostrato che il formaggio, quando abbinato al contenuto totale e di SFA del burro, determina un significativo abbassamento del C-LDL (116), confermando i risultati di dati osservazionali raccolti in precedenza. Da quel momento anche altri autori hanno messo in dubbio il ruolo dei SFA presenti nei latticini nei confronti della CVD, dimostrando che la sostituzione dei SFA dei latticini con (i) oli vegetali contenenti PUFA n-6 (a meno che non siano bilanciati con PUFA n-3) e con (ii) carboidrati ad elevato indice glicemico (GI), potrebbe andare anche ad influire negativamente sugli endpoint cardiometabolici (117). Più di recente Drouin-Chartier et al. hanno condotto un’ampia review ad ombrello dei dati ottenuti da meta-analisi di RCT, oltre che di un gran numero di singoli RCT. Pur notando che questi studi sono stati condotti prevalentemente su individui sani, contrariamente a Huth e Park (116), non hanno riportato alcun impatto negativo del consumo di latticini ad alto contenuto di SFA su molteplici variabili cardiometaboliche, comprese le varie frazioni lipidiche nel sangue, la pressione sanguigna, l’infiammazione e la funzionalità vascolare (126). Gli autori hanno evidenziato che la loro review narrativa non è riuscita a far fronte a diversi potenziali fattori di confondimento, tra cui il cambiamento del peso corporeo, i vari e multipli bracci di controllo (componenti dietetiche sia latticini che non latticini) utilizzati in questi interventi con latticini e la possibilità di inadeguata forza in più studi nei quali gli esiti CVD valutati non erano endpoint primari. Né hanno valutato le potenziali bias di pubblicazione. Tuttavia le conclusioni tratte da questa review, cioè che non vi erano prove ottenute da RCT a supporto di un effetto dannoso dei latticini regolari o di quelli ad elevato contenuto di grassi su questi numerosi fattori di rischio per CVD, concordavano con quelle degli studi osservazionali discussi sopra. La tabella 1c riassume anche le meta-analisi di RCT che studiano gli effetti dei vari componenti specifici del latte sui fattori di rischio di CVD. Brouwer et al. (75, 80) hanno individuato gli effetti avversi dei grassi trans in grandi meta-analisi di 48 studi su CLA industriali e di 11 RCT sui grassi trans prodotti dai ruminanti. Vari autori hanno riportato effetti avversi (96), positivi (87) e misti (89) del CLA sugli endpoint CV. Effetti positivi sono stati riportati anche in diverse meta-analisi di RCT sulle proteine del siero di latte (30, 32).
Tabella 1c Riassunto di meta-analisi, review sistematiche e review narrative che riportano esiti di CVD: RCT.
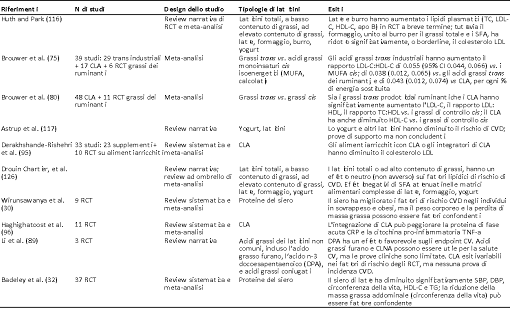
Apo B, apolipoproteina B; CI, intervallo di confidenza; CLA, acido linoleico coniugato; CLNA, acido linolenico coniugato; CRP, proteina reattiva C; CVD, patologia cardiovascolare; DBP, pressione ematica diastolica; DPA, acido docoesapentaenoico; HR, hazard ratio; IHD, patologia cardiaca ischemica; HDL-C, lipoproteina ad elevata densità-colesterolo; LDL-C, lipoproteina a bassa densità-colesterolo; MUFA, acidi grassi monoinsaturi; OCFA, acidi grassi a catena dispari; RCT, trial randomizzati controllati; RR, rischio relativo; SBP, pressione ematica sistolica; SFA, acidi grassi saturi; TC, colesterolo totale; TG, trigliceridi; TNF-α, fattoredi necrosi tumorale α; T2D, diabete di tipo 2.
Una delle principali lacune nell’interpretazione di questa evidenza è la mancanza di RCT a lungo termine sui latticini, nei quali l’incidenza di CVD rappresenti l’esito primario. Ad oggi, la maggior parte dei dati riportati proviene da interventi a breve termine in soggetti sani piuttosto che in soggetti ad alto rischio e valutano gli endpoint accessibili del rischio CV. Soltanto pochissimi interventi a lungo termine, come gli studi Finnish Dietary Prevention of Coronary Heart Disease per uomini e donne (152, 153), studi clinici di intervento della durata di 12 anni con cluster randomizzati che miravano alla riduzione dei SFA mediante la sostituzione dei latticini, hanno studiato gli endpoint di CVD. Questi sono stati condotti in due reparti ospedalieri di lunga degenza dove la maggior parte dei grassi provenienti dai latticini veniva sostituita da grassi PUFA n-6 di origine vegetale per un periodo di 6 anni, prima del crossover. In particolare c’è stata una significativa diminuzione del colesterolo sierico e dell’incidenza di patologia coronarica negli uomini, meno nelle donne, quando i latticini sono stati in gran parte sostituiti dai PUFA. Il dubbio se questa diminuzione degli eventi clinici sia stata determinata dalla diminuzione dei SFA (i latticini sostituiti includevano latte intero e burro) o dall’aumento dei PUFA (sostituti dei latticini olio di soia nel latte scremato e margarina morbida ad elevato contenuto di PUFA) non può essere risolto. La natura critica del braccio di confronto (o di “controllo”) nell’interpretazione di tali studi è stata recentemente evidenziata nella più ampia discussione sul ruolo dei SFA della dieta nella prevenzione della CVD (154). In una review sistematica di grandi interventi dietetici, l’analisi dei set di dati basati sulla sostituzione di SFA con i PUFA, con i CHO o con sostituti di cui si ignora la composizione, ha portato a relazioni positive (PUFA) o nulle (CHO, sconosciuto) abbastanza diverse tra SFA e CVD. Ciò evidenzia chiaramente la necessità di condurre RCT di lunga durata nei quali il braccio di controllo non rappresentato dai latticini venga attentamente pianificato e valutato.
T2D: Ancora una volta, come notato in precedenza, ci sono pochi dati disponibili da RCT a lungo termine che attribuiscono direttamente il miglioramento dei fattori di rischio del T2D, o della prevenzione del T2D, al consumo di latticini. Rideout et al. hanno condotto su di un campione di piccole dimensioni uno studio crociato della durata di 2 x 6 mesi, che ha evidenziato un miglioramento della sensibilità all’insulina (155), anche se si trattava nello specifico di latticini a basso contenuto di grassi. Al contrario, un secondo studio crociato della durata di 2 × 6 mesi non ha riportato alcun effetto di un consumo elevato, rispetto ad uno più basso, sugli endpoint glicemici (156). Uno studio più recente condotto su adulti iperinsulinemici che ha messo a confronto un consumo adeguato di 6 settimane di latticini (tre porzioni/settimana) versus un consumo elevato (tre porzioni/settimana), non ha osservato alcuna differenza negli esiti riguardanti glucosio o insulina, inclusa la sensibilità all’insulina, la secrezione di insulina e la funzione delle cellule β (157). La tabella 1d presenta un riepilogo delle review sistematiche, meta-analisi e review narrative. Una review sistematica di 10 RCT della durata da 1 settimana a 6 mesi, nello specifico in individui con peso stabile, non è riuscita a trovare prove conclusive di un miglioramento o dello svantaggio derivanti dal consumo di latticini sugli endpoint glicemici (158). Solo 4 RCT su 10 hanno avuto un esito positivo sulla sensibilità all’insulina valutata come HOMA-IR. Pasin e Commerford hanno riportato una meta-analisi di 28 RCT sui latticini, con prove limitate sui latticini fermentati, sui probiotici e sulle proteine del latte che sarebbero in grado di migliorare il controllo glicemico (27). Una review narrativa più recente di 15 RCT, della durata da 2 settimane a 6 mesi in soggetti a rischio di T2D, ha concluso che sebbene i latticini non abbiano effetti dannosi sugli esiti correlati al glucosio, i risultati positivi non sono unanimi (19). L’elevato consumo di latticini è stato messo a confronto con una serie di trattamenti che non prevedevano latticini o che ne prevedevano pochi. Dieci degli studi non hanno mostrato miglioramenti con un elevato consumo di latticini, mentre 5 studi hanno mostrato un miglioramento della HbA1c, del glucosio plasmatico e della resistenza all’insulina (HOMA-IR). Recentemente O’Connor et al. hanno pubblicato una review di 38 RCT, in una meta-analisi eterogenea di bambini (> 5 anni) ed adulti senza T2D, nella quale gli endpoint glicemici sono stati misurati in studi che prevedevano un confronto tra il braccio con un consumo di latticini superiore versus il braccio con un consumo inferiore (159). Un consumo particolarmente elevato di latticini è stato associato ad un peggioramento dell’FPG, ma non all’insulinemia a digiuno o all’HbA1c, e gli autori hanno rilevato che la qualità delle prove era bassa e con elevata incertezza. Anche Sohol et al., hanno recentemente condotto una meta-analisi di 30 RCT (160) ed hanno riportato che i latticini, in particolare quelli a basso contenuto di grassi, riducevano la resistenza all’insulina valutata dall’HOMA-IR. Gli autori hanno evidenziato una serie di limitazioni della loro analisi, inclusa l’assenza di discriminazione all’interno dei gruppi di latticini tra latte, formaggio, yogurt e tra le componenti come proteine del latte, Ca e vitamina D, nonché la mancanza di dati riguardanti le analisi HOMA-IR nei documenti originali e l’assenza dello status glicemico al basale. Hanno anche evidenziato la significativa eterogeneità nei RCT inclusi nella meta-analisi. La tabella 1d riassume una serie di altre review di RCT nei quali sono stati valutati gli effetti di singoli componenti del latte: il CLA e le proteine del siero di latte. Gli RCT che studiano gli effetti del CLA (88, 97) non hanno riportato effetti positivi significativi sugli endpoint glicemici, mentre gli interventi che coinvolgevano le proteine del siero di latte (30, 32) hanno causato una significativa diminuzione dell’FPG. Ancora una volta, un’importante omissione nell’interpretazione di questi RCT è il fatto che non sono stati condotti grandi interventi a lungo termine per indagare l’effetto dei latticini sull’incidenza del T2D. Ad oggi, la maggior parte dei dati riportati proviene da interventi a breve termine, con individui sia sani sia con alterazioni della tolleranza al glucosio, che valutano gli endpoint glicemici comunemente misurati.
Tabella 1d Riassunto delle meta-analisi, delle review sistematiche e delle review narrative che riportano esiti di T2D: RCT.
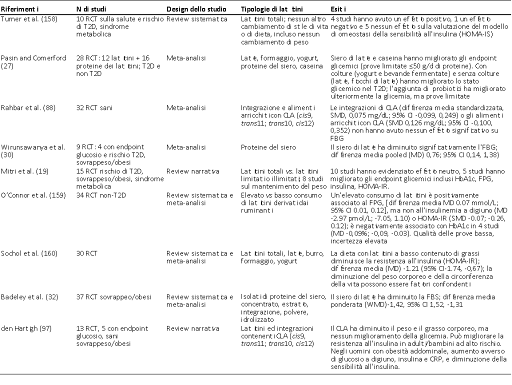
CI, intervallo di confidenza; CLA, acido linoleico coniugato; FBG, glucosio ematico a digiuno; HOMA-IR, modello omeostatico per la valutazione dell’insulino-resistenza; HOMA-IS, modello omeostatico per la valutazione della sensibilità all’insulina; MD, differenza media; RCT, trial controllati randomizzati; ow, sovrappeso; T2D, diabete di tipo 2; SMD, differenza media standardizzata; WMD, differenza media ponderata.
Effetti protettivi delle matrici di prodotti lattiero-caseari
Yogurt, formaggio
Come indicato nelle sezioni precedenti, la complessa matrice alimentare rappresentata dai latticini negli ultimi anni è stata proposta come capace di modulare significativamente le proprietà nutrizionali di questi alimenti (10, 25, 26, 161), agendo sia sugli endpoint acuti che su quelli cronici. Nel 2017 un gruppo di esperti, principalmente con sede in Europa, ha concluso che le prove dei RCT supportavano la proposta che il consumo di prodotti lattiero-caseari interi piuttosto che dei singoli costituenti del latte avesse diversi effetti cardiometabolici (25), e che ciò potesse essere alla base delle correlazioni protettive inverse comunemente riportate per i latticini fermentati, lo yogurt e i formaggi. Hanno proposto che la composizione degli alimenti e i metodi di lavorazione potrebbero migliorare le interazioni tra i nutrienti nella matrice, in modo tale che il valore nutritivo del prodotto non possa essere direttamente correlato al semplice contenuto di nutrienti, e introducendo il concetto di “bio-funzionalità” dei nutrienti all’interno dei latticini. Ad esempio, in un recente studio di intervento su adulti sani, nel quale venivano somministrati pasti ad elevato contenuto di grassi (e con un contenuto totale di grassi che combaciava) scegliendo tra una gamma di prodotti lattiero-caseari, si è osservata una risposta postprandiale piuttosto diversa delle frazioni sieriche di lipidi e lipoproteine (161). Il formaggio rappresenta un chiaro esempio, i cui previsti effetti avversi sulla salute cardiometabolica legati alla presenza di SFA migliorano quando questi acidi grassi vengono consumati come parte di questa complessa matrice ad elevato contenuto di grassi (10, 126, 129). Questi esiti apparivano inaspettati nei primi studi dove i grassi dei latticini ad elevato contenuto di SFA, quando somministrati sotto forma di formaggio, non facevano aumentare il colesterolo totale e il colesterolo LDL rispetto a diete di controllo a basso contenuto di SFA (162) o rispetto ai grassi del burro (163). Sono aumentate le prove a sostegno del fatto che il formaggio sia un alimento neutro che possa essere inserito in una dieta sana (164). Ciò è stato recentemente supportato in un position paper di un panel di esperti nel quale la matrice alimentare è stata segnalata come un determinante più forte degli effetti sulla salute rispetto al contenuto di SFA di per sé (18). Il formaggio viene prodotto in un’ampia gamma di formati che a loro volta variano notevolmente in termini di matrice alimentare, con conseguente variabilità nella risposta fisiologica. Ad esempio, un recente studio condotto sui formaggi commerciali ha mostrato che un formaggio “cremoso” (struttura morbida) induceva un aumento maggiore della trigliceridemia postprandiale rispetto al burro, mentre il formaggio cheddar (struttura dura) non faceva altrettanto. Presumibilmente ciò può essere collegato alla diversità nei processi di disintegrazione gastrointestinale (26). Un RCT a lungo termine ha mostrato che il grasso dei latticini consumato sotto forma di matrice di formaggio ha abbassato i marcatori lipidici rispetto al grasso dei latticini fornito tramite matrici alternative (10). Oltre al formaggio, abbiamo prove che anche lo yogurt non esercita gli effetti negativi sui lipidi del sangue previsti unicamente in base al contenuto di SFA (116, 117). Il panel di esperti ha notato che il consumo di yogurt è associato ad una diminuzione del rischio di T2D e di malattie cardiometaboliche (18), come discusso in precedenza in questa receview. Sebbene una serie di fattori possano contribuire, tra cui il basso contenuto di grassi totali, il processo di fermentazione e il contenuto di probiotici, la matrice alimentare viene proposta come un ulteriore significativo fattore contribuente. I meccanismi proposti a sostegno di questi effetti della matrice alimentare sono vari. I latticini stessi sono molto vari, costituiti da una vasta gamma di strutture e di metodi di lavorazione utilizzati per la loro produzione. Il formaggio ne è un buon esempio. Sulla base del contenuto di macroelementi, il formaggio è un latticino ad alto contenuto di grassi, così come il burro, ma in base alla composizione strutturale è più simile allo yogurt o al latte liquido con un alto contenuto di proteine, un alto contenuto di calcio e un alto contenuto di MFGM (25). È stato dimostrato che il ridotto assorbimento gastrointestinale (GI) dei lipidi provenienti dai latticini ricchi di calcio, fosforo e MFGM aumenta direttamente le perdite di lipidi dal tratto intestinale e quindi, a sua volta, diminuisce i livelli di lipidi circolanti, inclusi i trigliceridi dei chilomicroni (di origine alimentare) (165). Il calcio presente all’interno della matrice dei latticini è coinvolto nella soppressione del colesterolo LDL osservata durante un consumo prolungato di formaggio ad alto contenuto di grassi (25). È noto da tempo che il fosfato di calcio aumenta l’escrezione degli acidi biliari fecali, un meccanismo mediante il quale il colesterolo LDL viene eliminato, dato che gli acidi biliari sono sintetizzati dal colesterolo epatico e rappresentano la via principale del catabolismo del colesterolo. È meno chiaro se l’MFGM da sola influenzi anche l’escrezione di grasso fecale, con meccanismi alla base del miglioramento del profilo delle lipoproteine osservato quando, ad esempio, si consuma il grasso del burro con elevata MFGM, facendo diminuire o l’assorbimento del colesterolo GI e/o la regolazione dell’espressione genica (25). Anche i latticini fermentati hanno effetti benefici sui lipidi del sangue, probabilmente dovuti ad impatti benefici sul microbiota intestinale con conseguente profilo SCFA positivo. È stato confermato che sia lo yogurt che il formaggio aumentano i livelli di SCFA fecali, con il consumo di formaggio che aumenta il butirrato, il propionato e il malonato a livello fecale e diminuisce le concentrazioni di acetato e glicerolo (25). Inoltre, esistono correlazioni significative tra i livelli fecali di propionato e butirrato e le concentrazioni di colesterolo LDL.
Discussione
Il contributo dei latticini alla salute cardiometabolica è stato a lungo discusso. In particolare, su quali effetti negativi potrebbero avere i grassi trans contenuti nei latticini e i SFA di origine animale sugli esiti di T2D e CVD. L’unanimità sulle componenti dei latticini si è gradualmente raggiunta, viste alcune prove di associazioni positive tra le proteine del siero di latte, la caseina, la membrana dei globuli di grasso del latte (MFGM) e i fosfolipidi polari, la vitamina D, il calcio e gli endpoint cardiometabolici intermedi. Al contrario, non vi è consenso a sostegno della proposta secondo la quale sia i grassi trans dei latticini sia i grassi saturi avrebbero un costante effetto negativo sulla salute cardiometabolica. Studi di coorte riportano un effetto neutro da parte del trans-VA, ma non sono supportati da prove ottenute da RCT che dimostrino che gli acidi grassi contenenti doppi legami trans alterino negativamente il colesterolo sierico, indipendentemente dall’origine (prodotti dai ruminanti o industriali). Nei RCT, il CLA migliora e peggiora significativamente i fattori di rischio CV, ma con uno scarso effetto sulla glicemia, e negli studi osservazionali ha un’associazione limitata con l’aumento dell’incidenza CV. Per i SFA dei latticini, sono aumentate le prove a sostegno di un’associazione nulla o anche dell’esistenza di una correlazione inversa protettiva con la salute cardiometabolica, in gran parte promossa da studi di coorte osservazionali. Una chiara lacuna della ricerca è la limitata evidenza causale di miglioramenti nell’incidenza della malattia ottenuta da studi di intervento, con prove da RCT ottenute prevalentemente da individui sani e in studi di breve o modesta durata. Inoltre, si propone che gli effetti negativi previsti dal consumo di questi lipidi dei latticini possano essere migliorati se il loro consumo avvenisse nel contesto di complesse matrici alimentari come latte liquido, formaggio fermentato o yogurt. Nel condurre questa review ad ampio spettro delle correlazioni esistenti tra i latticini, la miriade di alimenti e componenti ad essi associati e la salute cardiometabolica, ci sono necessariamente una serie di limitazioni. Innanzitutto si tratta di una review narrativa e non sistematica, quindi la capacità di valutare formalmente i bias nelle loro molteplici forme e nel gran numero di pubblicazioni incluse (sia come singoli studi che come contributo ad altre review narrative o sistematiche) è limitata. La qualità degli studi osservazionali esaminati era molto variabile, così come i parametri di progettazione degli RCT. Anche l’età, il sesso, gli indici antropometrici, lo stato di salute e i fattori di rischio cardiometabolico dei partecipanti allo studio variavano notevolmente tra gli studi, sia all’interno dello studio sia tra le tipologie dello studio. Non è chiaro se i benefici siano maggiori negli individui identificati come a rischio di malattia futura. Nei RCT la dimensione del campione, la composizione del braccio di confronto (“controllo”), il consumo di latticini al basale, il prodotto lattiero-caseario, la dose di confronto e la durata dell’intervento sono esempi di parametri importanti che non vengono corretti in una review narrativa. Attualmente, c’è poca unanimità da parte delle linee guida dietetiche internazionali sul contenuto di grassi dei latticini da raccomandare e sul fatto se sia giustificata la continua attenzione rivolta verso il consumo di latticini a basso contenuto di grassi. La questione è complessa ed è necessario tenere in considerazione sia la qualità che la quantità dei lipidi che caratterizzano la dieta e che derivano dai latticini, visto che i prodotti ad elevato contenuto di grassi hanno il potenziale di promuovere una dieta ad alta densità energetica (166, 167) e l’aumento di peso corporeo (168). La variabilità alimentare, ovvero “ il mangiare una certa varietà di cibi”, è diventata una raccomandazione gradualmente accettata per promuovere una dieta sana e ridurre il rischio di malattie cardiometaboliche; tuttavia recenti prove presentate da studi di coorte hanno dimostrato che questo aumento della variabilità è associato a cattive abitudini alimentari e, di conseguenza, all’aumento di peso e all’obesità. Ad esempio, si può notare un aumento del consumo di alimenti lavorati, cereali raffinati e anche di bevande zuccherate (SSB) e una diminuzione del consumo di alimenti non trasformati come pesce, frutta e verdura (169). La tabella 2 presenta le raccomandazioni dietetiche attualmente consigliate dalle associazioni mediche statunitensi ed europee per la prevenzione di CVD e T2D, dove i latticini a basso contenuto di grassi sono più comunemente inclusi.
Tabella 2 Attuali raccomandazioni dietetiche provenienti dalle associazioni mediche sia dell’Europa che degli Stati Uniti per la prevenzione della CVD e del T2D.
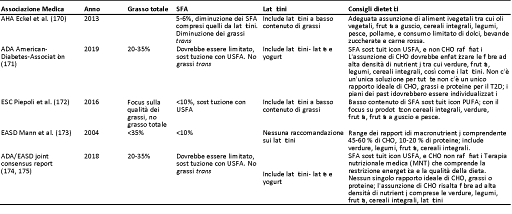
AHA, American Heart Association; ADA, American Diabetes Association; ESC, European Society of Cardiology; EASD, European Association for the Study of Diabetes; CHO, carboidrati; T2D, diabete di tipo 2; SFA, acidi grassi saturi; USFA, acidi grassi insaturi; %, percentuale di energia totale.
Le raccomandazioni sulla dieta e sullo stile di vita dell’American Heart Association (AHA) (170, 176), continuano a promuovere un modello alimentare sano che dia la precedenza al consumo di latticini a basso contenuto di grassi accompagnato da un’adeguata assunzione di alimenti vegetali tra cui oli vegetali, frutta a guscio, cereali integrali, legumi, ma anche pesce e pollame e che limiti il consumo di dolci, SSB e carne rossa. Dall’altro lato, le linee guida annuali dell’American Diabetes Association (ADA) continuano a raccomandare il consumo di un’ampia gamma di prodotti lattiero-caseari come parte di una dieta sana, inclusi latte e yogurt, per i soggetti con T2D (171), senza alcuna promozione specifica di latticini a basso contenuto di grassi. Le linee guida della European Society for Cardiology (ESC) (172) e le linee guida dell’European Association for the Study of Diabetes (EASD) gruppo di studio diabete e alimentazione (DNSG) (173), che dovrebbero essere aggiornate nel 2020 (177), forniscono entrambe raccomandazioni sui SFA che dovrebbero essere < 10 % e sui grassi trans che dovrebbero essere bassi. Oltre ad altre raccomandazioni per un’alimentazione sana che consigliano di adottare una dieta ricca di verdure, legumi, frutta e cereali integrali, l’EASD non fa alcun riferimento specifico ai latticini, mentre l’ESC raccomanda elementi della dieta mediterranea con un quantitativo minimo di latticini per la prevenzione delle malattie cardiovascolari e di latticini a basso contenuto di grassi per il trattamento dell’ipertensione. Un report congiunto sulla gestione dell’iperglicemia di ADA (174) e EASD (175), pubblicato contemporaneamente nel 2018, includeva raccomandazioni sulla dieta e sull’attività fisica, e poneva particolare attenzione sulla terapia nutrizionale medica (MNT) caratterizzata sia da restrizione energetica che da qualità dietetica ottimale, che prevedesse verdure, legumi, frutta e cereali integrali, oltre all’introduzione di latticini. Questo fa parte della risposta “non esiste una cosa che vada bene per tutti” quando si parla di dieta e di T2D, affermata da parte dell’ADA nel loro più recente Consensus Report del 2019 (171). Il contributo del latte vaccino, e della miriade di prodotti da esso derivati, alla salute cardiometabolica è un’area di ricerca attiva e ancora in via di sviluppo. Ampi studi di coorte, review sistematiche e meta-analisi ad oggi indicano un’associazione inversa neutra, o addirittura protettiva, dei latticini nei confronti di CVD e T2D, ma mancano ancora RCT a lungo termine. Tali studi a lungo termine ben controllati sono utili per costruire una base di prove causa-effetto necessarie per raggiungere finalmente l’unanimità in questo duraturo e controverso ambito della scienza della nutrizione.
REVIEW article
Front. Nutr., 08 December 2020 | https://doi.org/10.3389/fnut.2020.574725
Cow’s Milk and Dairy Consumption: Is There Now Consensus for Cardiometabolic Health?
Sally D. Poppitt
Human Nutrition Unit, Department of Medicine, School of Biological Sciences, University of Auckland, Auckland, New Zealand.
Riferimenti
1. Hu F, Stampfer M, Manson J. Dietary saturated fats and their food sources in relation to the risk of coronary heart disease in women. Am J Clin Nutr. (1999) 70:1001–8. doi: 10.1093/ajcn/70.6.1001
2. Lovegrove J, Givens D. Dairy food products: good or bad for cardiometabolic disease? Nutr Res Rev. (2016) 29:249–67. doi: 10.1017/S0954422416000160
3. Astrup A, Magkos F, Bier DM, Brenna J, de Oliveira Otto TMC, Hill JO, et al. Saturated fats and health: a reassessment and proposal for food-based recommendations: JACC state-of-the-art review. J Am Coll Cardiol. (2020) 76:844–57. doi: 10.1016/j.jacc.2020.05.077
4. Elwood P, Pickering J, Givens D, Gallacher J. The consumption of milk and dairy foods and the incidence of vascular disease and diabetes: an overview of the evidence. Lipids. (2010) 45:925–39. doi: 10.1007/s11745-010-3412-5
5. Soedamah-Muthu SS, Ding EL, Al-Delaimy WK, Hu FB, Engberink MF, Willett WC, et al. Milk and dairy consumption and incidence of cardiovascular diseases and all-cause mortality: dose-response metaanalysis of prospective cohort studies. Am J Clin Nutr. (2011) 93:158– 71. doi: 10.3945/ajcn.2010.29866
6. Qin L, Xu J, Han S, Zhang Z, Zhao Y, Szeto I. Dairy consumption and risk of cardiovascular disease: an updated meta-analysis of prospective cohort studies. Asia Pac J Clin Nutr. (2015) 24:90–100. doi: 10.6133/apjcn.2015.24.1.09
7. Alexander D, Bylsma L, Vargas A, Cohen S, Doucette A, Mohamed M, et al. Dairy consumption and CVD: a systematic review and meta-analysis. Br J Nutr. (2016) 115:737–50. doi: 10.1017/S0007114515005000
8. Gholami F, Khoramdad M, Esmailnasab N, Moradi G, Nouri B, Safiri S, et al. The effect of dairy consumption on the prevention of cardiovascular diseases: A meta-analysis of prospective studies. J Cardiovasc Thorac Res. (2017) 9:1–11. doi: 10.15171/jcvtr.2017.01
9. Godos J, Tieri M, Ghelfi F, Titta L, Marventano S, Lafranconi A, et al. Dairy foods and health: an umbrella review of observational studies. Int J Food Sci Nutr. (2020) 71:138–51. doi: 10.1080/09637486.2019.1625035
10. Feeney EL, Barron R, Dible V, Hamilton Z, Power Y, Tanner L, et al. Dairy matrix effects: response to consumption of dairy fat differs when eaten within the cheese matrix-a randomized controlled trial. Am J Clin Nutr. (2018) 108:667–74. doi: 10.1093/ajcn/nqy146
11. Hansson P, Holven K, Øyri L, Brekke H, Gjevestad G, Thoresen M, et al. Sex differences in postprandal responses to different dairy products on lipoprotein subclasses: a randomized controlled cross-over trial. Br J Nutr. (2019) 18:1–25. doi: 10.1017/S0007114519001429
12. Tong X, Dong J, Wu Z, Li W, Qin L. Dairy consumption and risk of type 2 diabetes mellitus: a meta-analysis of cohort studies. Eur J Clin Nutr. (2011) 65:1027–31. doi: 10.1038/ejcn.2011.62
13. Aune D, Norat T, Romundstad P, Vatten L. Dairy products and the risk of type 2 diabetes: a systematic review and dose-response meta-analysis of cohort studies. Am J Clin Nutr. (2013) 98:1066–8. doi: 10.3945/ajcn.113.059030
14. Gao D, Ning N, Wang C, Wang Y, Li Q, Meng Z, et al. Dairy products consumption and risk of type 2 diabetes: systematic review and dose-response meta-analysis. PLoS ONE. (2013) 8:e73965. doi: 10.1371/journal.pone.0073965
15. Chen M, Sun Q, Giovannucci E, Mozaffarian D, Manson J, Willett W, et al. Dairy consumption and risk of type 2 diabetes: 3 cohorts of US adults and an updated meta-analysis. BMC Med. (2014) 12:215. doi: 10.1186/s12916-014-0215-1
16. Gijsbers L, Ding EL, Malik VS, de Goede J, Geleijnse JM, Soedamah-Muthu SS. Consumption of dairy foods and diabetes incidence: a dose-response meta-analysis of observational studies. Am J Clin Nutr. (2016) 103:1111–24. doi: 10.3945/ajcn.115.123216
17. Alvarez-Bueno C, Cavero-Redondo I, Martinez-Vizcaino V, Sotos-Prieto M, Ruiz J, Gil A. Effects of milk and dairy product consumption on type 2 diabetes: overview of systematic reviews and meta-analyses. Adv Nutr. (2019) 10:S154–63. doi: 10.1093/advances/nmy107
18. Guo J, Givens DI, Astrup A, Bakker SJ L, Goossens GH, Kratz M, et al. The impact of dairy products in the development of type 2 diabetes: where does the evidence stand in 2019? Adv Nutr. (2019) 10:1066–75. doi: 10.1093/advances/nmz050
19. Mitri J, Mohd Yusof BN, Maryniuk M, Schrager C, Hamdy O, Salsberg V. Dairy intake and type 2 diabetes risk factors: a narrative review. Diabetes Metab Syndr. (2019) 13:2879–87. doi: 10.1016/j.dsx.2019.07.064
20. Yu E, Hu F. Dairy products, dairy fatty acids, and the prevention of cardiometabolic disease: a review of recent evidence. Curr Atheroscler Rep. (2018) 20:24. doi: 10.1007/s11883-018-0724-z
21. Comerford K, Pasin G. Emerging evidence for the importance of dietary protein source on glucoregulatory markers and type 2 diabetes: different effects of dairy, meat, fish, egg, and plant protein foods. Nutrients. (2016) 8:446. doi: 10.3390/nu8080446
22. Mozaffarian D, Wu J. Flavonoids, dairy foods, and cardiovascular and metabolic health: a review of emerging biologic pathways. Circ Res. (2019) 122:369–84. doi: 10.1161/CIRCRESAHA.117.309008
23. Astrup A, Dyerberg J, Elwood P, Hermansen K, Hu F, Jakobsen M, et al. The role of reducing intakes of saturated fat in the prevention of cardiovascular disease: where does the evidence stand in 2010? Am J Clin Nutr. (2011) 93:684–8. doi: 10.3945/ajcn.110.004622
24. Mozaffarian D. Dietary and policy priorities for cardiovascular disease, diabetes, and obesity: a comprehensive review. Circulation. (2016) 133:187– 225. doi: 10.1161/CIRCULATIONAHA.115.018585
25. Thorning TK, Bertram HC, Bonjour JP, de Groot L, Dupont D, Feeney E, et al. Whole dairy matrix or single nutrients in assessment of health effects: current evidence and knowledge gaps. Am J Clin Nutr. (2017) 105:1033–45. doi: 10.3945/ajcn.116.151548
26. Turgeon S, Brisson G. Symposium review: The dairy matrix: Bioaccessibility and bioavailability of nutrients and physiological effects. J Dairy Sci. (2019) 19:6727–36. doi: 10.3168/jds.2019-17308
27. Pasin G, Comerford K. Dairy foods and dairy proteins in the management of type 2 diabetes: a systematic review of the clinical evidence. Adv Nutr. (2015) 6:245–59. doi: 10.3945/an.114.007690
28. Poppitt SD. Milk proteins human health. In: Singh BM. Chapter18. Milk Proteins: from Expression to Food. London: Academic Press (2019). doi: 10.1016/B978-0-12-815251-5.00018-9
29. Berry S, Sheehy P, Williamson P, Sharp J, Menzies K, Lefevre C, et al. Defining the origin function of bovine milk proteins through genomics: The biological implications of manipulation modification. In: BM Singh, editor. Milk Proteins: From Expression to Food. London: Academic Press (2020). doi: 10.1016/B978-0-12-815251-5.00004-9
30. Wirunsawanya K, Upala S, Jaruvongvanich V, Sanguankeo A. Whey protein supplementation improves body composition and cardiovascular risk factors in overweight and obese patients: A systematic review and meta-analysis. J Am Coll Nutr. (2018) 37:60–70. doi: 10.1080/07315724.2017.1344591
31. Hodgson JM, Zhu K, Lewis J. R., Kerr D, Meng X, Solah V, et al. Long-term effects of a protein-enriched diet on blood pressure in older women. Br J Nutr. (2012) 107:1664–72. doi: 10.1017/S0007114511004740
32. BadelyM, SepandiM, SamadiM, Parastouei K, TaghdirM. The effect of whey protein on the components of metabolic syndrome in overweight and obese individuals; a systematic review and meta-analysis. Diabetes Metab Syndr. (2019) 13:3121–31. doi: 10.1016/j.dsx.2019.11.001
33. Bergia RE, Hudson JL, Campbell WW. Effect of whey protein supplementation on body composition changes in women: A systematic review and meta-analysis. Nutr Rev. (2018)
76:539–51. doi: 10.1093/nutrit/nuy017
34. Hruby A, Jacques PF. Dietary protein and changes in markers of cardiometabolic health across 20 years of follow-up in middle-aged Americans. Public Health Nutr. (2018) 21:2998–
3010. doi: 10.1017/S1368980018001854
35. Rietman A, Schwarz J, Tom,é D, Kok FJ, and Mensink M. High dietary protein intake, reducing or eliciting insulin resistance? Eur J Clin Nutr. (2014) 68:973–9. doi: 10.1038/ejcn.2014.123
36. Sluik D, Brouwer-Brolsma EM, Berendsen AA M, Mikkil,ä V, Poppitt SD, et al. Protein intake and the incidence of pre-diabetes and diabetes in 4 population-based studies: the PREVIEW project. Am J Clin Nutr. (2019) 109:1310–8. doi: 10.1093/ajcn/nqy388
37. Song Y, Manson JE, Buring JE, Liu S. A prospective study of red meat consumption and type 2 diabetes in middle-aged and elderly women: the women’s health study. Diabetes Care. (2004) 27:2108–15. doi: 10.2337/diacare.27.9.2108
38. Adeva-AndanyMM, Rañal-Muíño E, Vila-AltesorM, Fernández-Fernández C, Funcasta-Calderón R, Castro-Quintela E. Dietary habits contribute to define the risk of type 2 diabetes in humans. Clin Nutr ESPEN. (2019) 34:8–17. doi: 10.1016/j.clnesp.2019.08.002
39. Sluijs I, Beulens JWJDL, Van Der A, Spijkerman AMW, Grobbee DE, van der Schouw YT. Dietary intake of total, animal, and vegetable protein and risk of type 2 diabetes in the European Prospective Investigation into Cancer and Nutrition (EPIC)-NL study. Diabetes Care. (2010) 33:43–8. doi: 10.2337/dc09-1321
40. Fan M, Li Y, Wang C, Mao Z, Zhou W, Zhang L, et al. Dietary protein consumption and the risk of type 2 diabetes: A dose-response meta-analysis of prospective studies. Nutrient. (2011) 15: 2783. doi: 10.3390/nu11112783
41. Almario RU, Buchan WM, Rocke DM, Karakas SE. Glucose-lowering effect of whey protein depends upon clinical characteristics of patients with type 2 diabetes. BMJ Open Diabetes Res Care. (2017) 5:e000420. doi: 10.1136/bmjdrc-2017-000420
42. Karakas SE. www.clinicaltrials.gov. Bethesda (MD): National Library of Medicine (US); 2013. NCT01925248: Can whey protein improve glycemic control in type 2 diabetes? Available online at:http://clinicaltrials.gov/ct2/show/NCT01925248 (Accessed 4 Sept 2020).
43. Jakubowicz D, Wainstein J, Landau Z, Ahren B, Barnea M, Bar-Dayan Y, et al. High-energy breakfast based on whey protein reduces body weight, postprandial glycemia and HbA(1C) in Type 2 diabetes. J Nutr Biochem. (2017) 49:1–7. doi: 10.1016/j.jnutbio.2017.07.005
44. Liu AY, Silvestre MP, Poppitt SD. Prevention of type 2 diabetes through lifestyle modification: is there a role for higher-protein diets? Adv Nutr. (2015) 13:665–73. doi: 10.3945/an.115.008821
45. Fogelholm M, Larsen T, Westerterp-Plantenga M, Macdonald I, Martinez A, Boyadjieva N, et al. PREVIEW: PREVention of diabetes through lifestyle Intervention and population studies in Europe and around the World. Design, methods and baseline participant description of an adult
cohort enrolled into a 3-year randomized clinical trial. Nutrients. (2017) 9:632. doi: 10.3390/nu9060632
46. Mignone LE, Wu T, Horowitz M, and Rayner CK. Whey protein: The whey forward for treatment of type 2 diabetes?. World J Diabetes. (2015) 6:1274–84. doi: 10.4239/wjd.v6.i14.1274
47. Bloomgarden Z. Diabetes and branched-chain amino acids:What is the link? J Diabetes. (2018) 10:350–2. doi: 10.1111/1753-0407.12645
48. Chartrand D, Da Silva M, Julien P, Rudkowska I. Influence of amino acids in dairy products on glucose homeostasis: the clinical evidence. Can J Diabetes. (2017) 41:329–37. doi: 10.1016/j.jcjd.2016.10.009
49. Teng M, Zhao YJ, Khoo AL, Yeo TC, Yong QW, Lim BP. Impact of coconut oil consumption on cardiovascular health: a systematic review and meta-analysis. Nutr Rev. (2020) 78:249–59. doi: 10.1093/nutrit/nuz074
50. Poppitt SD, Strik CS, MacGibbon AK, McArdle BH, Budgett S, McGill AT. Fatty acid chain length, postprandial satiety and food intake in lean men. Physiol Behav. (2010) 101:161–7. doi: 10.1016/j.physbeh.2010.04.036
51. Turner N, Hariharan K, TidAng J, Frangioudakis G, Beale SM, Wright LE, et al. Enhancement of muscle mitochondrial oxidative capacity and alterations in insulin action are lipid species dependent: potent tissuespecific effects of medium-chain fatty acids. Diabetes. (2009) 58:2547–54. doi: 10.2337/db09-0784
52. Montgomery MK, Osborne B, Brown SH, Small L,Mitchell TW, Cooney GJ, et al. Contrasting metabolic effects of medium- versus long-chain fatty acids in skeletal muscle. J Lipid Res. (2013) 54:3322–33. doi: 10.1194/jlr.M040451
53. Chamma C. M., Bargut, T. CCA, Mandarim-de-Lacerda, and Aguila, M. B. A rich medium-chain triacylglycerol diet benefits adiposity but has adverse effects on the markers of hepatic lipogenesis and betaoxidation. Food & Function. (2017) 8:778–87. doi: 10.1039/C6FO01663D
54. Matualatupauw JC, Bohl M, Gregersen S, Hermansen K, Afman LA. Dietary medium-chain saturated fatty acids induce gene expression of energy metabolism-related pathways in adipose tissue of abdominally obese subjects. Int J Obes. (2017) 41:1348–54. doi: 10.1038/ijo.2017.120
55. Amer B, Clausen MR, Bertram HC, Bohl M, Nebel C, Zheng H, et al. Consumption of whey in combination with dairy medium-chain fatty acids (MCFAs) may reduce lipid storage due to urinary loss of tricarboxylic acid cycle intermediates and increased rates of MCFAs oxidation. Mol Nutr Food Res. (2017) 61. doi: 10.1002/mnfr.201601048
56. Bohl M, Bjørnshave A, Larsen MK, Gregersen S, Hermansen K. The effects of proteins and medium-chain fatty acids from milk on body composition, insulin sensitivity and blood pressure in abdominally obese adults. Eur J Clin Nutr. (2017) 71:76–82. doi: 10.1038/ejcn.2016.207
57. Poppitt SD, Kilmartin P, Butler P, Keogh GF. Assessment of erythrocyte phospholipid fatty acid composition as a biomarker for dietaryMUFA, PUFA or saturated fatty acid intake in a controlled cross-over intervention trial. Lipids Health Dis. (2005) 4:30. doi: 10.1186/1476-511X-4-30
58. Imamura F, Fretts A, Marklund M, Ardisson-Korat AV, Yang WS, Lankinen M, et al. Fatty acid biomarkers of dairy fat consumption and incidence of type 2 diabetes: A pooled analysis of prospective cohort studies. PLoS Med. (2011) 15:e1002670. doi: 10.1371/journal.pmed.1002670
59. Smedman AE, Gustafsson IB, Berglund LG, Vessby BO. Pentadecanoic acid in serum as a marker for intake of milk fat: relations between intake of milk fat and metabolic risk factors. Am J Clin Nutr. (1999) 69:22–9. doi: 10.1093/ajcn/69.1.22
60. Wolk A, Furuheim M, Vessby BO. Fatty acid composition of adipose tissue and serum lipids are valid biological markers of dairy fat intake in men. J Nutr. (2001) 131:828–33. doi: 10.1093/jn/131.3.828
61. Jenkins B, West J, Koulman A. A review of odd-chain fatty acid metabolism and the role of pentadecanoic acid (c15:0) and heptadecanoic acid (c17:0) in health and disease. Molecules. (2015)
20:2425–44. doi: 10.3390/molecules20022425
62. Pfeuffer M, Jaudszus A. Pentadecanoic and heptadecanoic acids: Multifaceted odd-chain fatty acids. Adv Nutr. (2016) 7:730–4. doi: 10.3945/an.115.011387
63. Risérus U, Marklund M. Milk fat biomarkers and cardiometabolic disease. Curr Opin Lipidol. (2017) 28:46–51. doi: 10.1097/MOL.0000000000000381
64. Venn-Watson S, Lumpkin R, Dennis EA. Efficacy of dietary oddchain saturated fatty acid pentadecanoic acid parallels broad associated health benefits in humans: Could it be essential? Sci Rep. (2017) 10:8161. doi: 10.1038/s41598-020-64960-y
65. Anto L, Warykas SW, Torres-Gonzalez M, Blesso CN. Milk polar lipids: underappreciated lipids with emerging health benefits. Nutrients. (2020) 12:E1001. doi: 10.3390/nu12041001
66. Reis MG, Roy NC, Bermingham EN, Ryan L, Bibiloni R, Young W, et al. Impact of dietary dairy polar lipids on lipid metabolismof mice fed a high-fat diet. JAgric Food Chem. (2013) 61:2729–38. doi: 10.1021/jf303795b
67. Rosqvist F, Smedman A, Lindmark-Månsson H, Paulsson M, Petrus P, Straniero S, et al. Potential role of milk fat globule membranein modulating plasma lipoproteins, gene expression, and cholesterolmetabolism in humans: a randomized study. Am J Clin Nutr. (2015) 102:20–30. doi: 10.3945/ajcn.115.107045
68. Vors C, Joumard-Cubizolles L, Lecomte M, Combe E, Ouchchane L, Drai J, et al. Milk polar lipids reduce lipid cardiovascular risk factors in overweight postmenopausal women: towards a gut sphingomyelin-cholesterol interplay. Gut. (2020) 69:487–501. doi: 10.1136/gutjnl-2018-318155
69. Nestel P, Straznicky N, Mellett N, Wong G, De Souza D, Tull D, et al. Specific plasma lipid classes and phospholipid fatty acids indicative of dairy food consumption associate with insulin sensitivity. Am J Clin Nutr. (2014) 99:46–53. doi: 10.3945/ajcn.113.071712
70. Zhou AL, Ward RE. Milk polar lipids modulate lipid metabolism, gut permeability, and systemic inflammation in high-fat-fed C57BL/6J ob/ob mice, a model of severe obesity. J Dairy Sci. (2019) 102:4816– 31. doi: 10.3168/jds.2018-15949
71. Norris GH, Milard M, Michalski MC, Blesso CN. Protective properties of milk sphingomyelin against dysfunctional lipid metabolism, gut dysbiosis, and inflammation. J Nutr Biochem. (2019)
73:108224. doi: 10.1016/j.jnutbio.2019.108224
72. Liu Z, Li C, Pryce J, Rochfort S. Comprehensive characterization of bovine milk lipids: Phospholipids, sphingolipids, glycolipids and ceramides. J Agric Food Chem. (2020) 68:6726–38. doi: 10.1021/acs.jafc.0c 01604
73. Cohn JS, Kamili A, Wat E, Chung R, Tandy, S. Dietary phospholipids and intestinal cholesterol absorption. Nutrients. (2010) 2:116–27. doi: 10.3390/nu2020116
74. Field CJ, Blewett HH, Proctor SD, Vine D. Human health benefits of vaccenic acid. Appl Physiol Nutr Metab. (2009) 34:979–91. doi: 10.1139/H09-079
75. Brouwer IA, Wanders AJ, Katan MB. Effect of animal and industrial trans fatty acids on HDL and LDL cholesterol levels in humans-a quantitative review. PLoS ONE. (2010) 5:e9434. doi: 10.1371/journal.pone.0009434
76. Gebauer SK, Destaillats F, Dionisi F, Krauss RM, Baer DJ. Vaccenic acid and trans fatty acid isomers from partially hydrogenated oil both adversely affect LDL cholesterol: a double-blind, randomized controlled trial. AmJ Clin Nutr. (2015) 102:1339–46. doi: 10.3945/ajcn.115.116129
77. Wang X, Gupta J, Kerslake M, Rayat G, Proctor SD, Chan CB. Trans-11 vaccenic acid improves insulin secretion in models of type 2 diabetes in vivo and in vitro. Mol Nutr Food Res. (2016) 60:846–57. doi: 10.1002/mnfr.201500783
78. Wang Y, Lu J, Ruth MR, Goruk SD, Reaney MJ, Glimm DR, et al. Trans- 11 vaccenic acid dietary supplementation induces hypolipidemic effects in JCR:LA-cp rats. J Nutr. (2008) 138:2117–22. doi: 10.3945/jn.108.091009
79. Jacome-SosaMM, Borthwick F,Mangat R, Uwiera R, ReaneyMJ, Shen J, et al. Diets enriched in trans-11 vaccenic acid alleviate ectopic lipid accumulation in a rat model of NAFLD and metabolic syndrome. J Nutr Biochem. (2014) 25:692–701. doi: 10.1016/j.jnutbio.2014.02.011
80. Brouwer IA, Wanders AJ, Katan MB. Trans fatty acids and cardiovascular health: research completed? Eur J Clin Nutr. (2013) 67:541–7. doi: 10.1038/ejcn.2013.43
81. Guillocheau E, Legrand P, Rioux V. Trans-palmitoleic acid (trans-9-C16:1, or trans-C16:1 n-7): Nutritional impacts, metabolism, origin, compositional data, analytical methods and chemical synthesis. A review Biochimie. (2020) 169:144–60. doi: 10.1016/j.biochi.2019.12.004
82. Jaudszus A, Kramer R, Pfeuffer M, Roth A, Jahreis G, Kuhnt K. Trans palmitoleic acid arises endogenously from dietary vaccenic acid. Am J Clin Nutr. (2014) 99:431–5. doi: 10.3945/ajcn.113.076117
83. Ratnayake WM. Concerns about the use of 15:0, 17:0, and trans-16:1n-7 as biomarkers of dairy fat intake in recent observational studies that suggest beneficial effects of dairy food on incidence of diabetes and stroke. Am J Clin Nutr. (2015) 101:1102–3. doi: 10.3945/ajcn.114.105379
84. GamaMAS, Filho H. G. B, Bizzo HR, Antoniassi R. Analytical shortcomings and other considerations related to the identification of biomarkers of dairy fat intake. Eur J Clin Nutr. (2017) 71:1022–3. doi: 10.1038/ejcn.2017.107
85. Mosley EE, Shafii B, Moate PJ, McGuire MA. cis-9, trans-11 conjugated linoleic acid is synthesized directly from vaccenic acid in lactating dairy cattle. J Nutr. (2006) 136:570–5. doi: 10.1093/jn/136.3.570
86. Koba K, Yanagita T. Health benefits of conjugated linoleic acid (CLA). Obes Res Clin Pract. (2014) 8:e525–32. doi: 10.1016/j.orcp.2013.10.001
87. Derakhshande-Rishehri SM, Mansourian M, Kelishadi R, Heidari- Beni M. Association of foods enriched in conjugated linoleic acid (CLA) and CLA supplements with lipid profile in human studies: a systematic review and meta-analysis. Public Health Nutr. (2015)18:2041–54. doi: 10.1017/S1368980014002262
88. Rahbar AR, Ostovar A, Derakhshandeh-Rishehri SM, Janani L, Rahbar A. Effect of conjugated linoleic acid as a supplement or enrichment in foods on blood glucose and waist circumference in humans: A meta-analysis. Endocr Metab Immune Disord Drug Targets. (2017) 17:5–18. doi: 10.2174/1570161115999170207113803
89. Li K, Sinclair AJ, Zhao F, Li D. Uncommon fatty acids and cardiometabolic health. Nutrients. (2018) 10. doi: 10.3390/nu10101559
90. Smit LA, Baylin A, Campos H. Conjugated linoleic acid in adipose tissue and risk of myocardial infarction. Am J Clin Nutr. (2010) 92:30–4. doi: 10.3945/ajcn.2010.29524
91. Sluijs I, Plantinga Y, De Roos B, Mennen LI, Bots ML. Dietary supplementation with cis-9,trans-11 conjugated linoleic acid and aortic stiffness in overweight and obese adults. Am J Clin Nutr. (2010) 91:175–83. doi: 10.3945/ajcn.2009.28192
92. Raff M, Tholstrup T, Basu S, Nonboe P, Sorensen MT, Straarup EM. A diet rich in conjugated linoleic acid and butter increases lipid peroxidation but does not affect atherosclerotic, inflammatory, or diabetic risk markers in healthy young men. J Nutr. (2008) 138:509–51. doi: 10.1093/jn/138.3.509
93. Eftekhari M, Aliasghari F, Beigi MA, Hasanzadeh J. The effect of conjugated linoleic acids and omega-3 fatty acids supplementation on lipid profile in atherosclerosis. Adv Biomed Res. (2014) 3:15. doi: 10.4103/2277-9175.124644
94. Hassan Eftekhari M, Aliasghari F, Babaei-Beigi MA, Hasanzadeh J. Effect of conjugated linoleic acid and omega-3 fatty acid supplementation on inflammatory and oxidative stress markers in atherosclerotic patients. ARYA Atheroscler. (2013) 9:311–31.
95. Derakhshandeh-Rishehri SM, Rahbar AR, Ostovar A. Effects of conjugated linoleic acid intake in the form of dietary supplement or enriched food on C-reactive protein and lipoprotein (a) levels in humans: A literature review and meta-analysis. Iran J Med Sci. (2019) 44:359–73.
96. Haghighatdoost FB, Nobakht-M-Gh F. Effect of conjugated linoleic acid on blood inflammatory markers: a systematic review and meta-analysis on randomized controlled trials. Eur J Clin Nutr. (2018) 72:1071–82. doi: 10.1038/s41430-017-0048-z
97. den Hartigh LJ. Conjugated linoleic acid effects on cancer, obesity, and atherosclerosis: A review of pre-clinical and human trials with current perspectives. Nutrients. (2019) 11:370. doi: 10.3390/nu11020370
98. Itkonen ST, Erkkola M, Lamberg-Allardt CJ. Vitamin D fortification of fluid milk products and their contribution to vitamin D intake and vitamin D status in observational studies – A review. Nutrients. (2018) 10:1054. doi: 10.3390/nu10081054
99. Muñoz-Garach A, García-Fontana B, Muñoz-Torres M. Vitamin D status, calcium intake and risk of developing type 2 diabetes: An unresolved issue. Nutrients. (2019) 11:642. doi: 10.3390/nu11030642
100. Mitri J, Muraru MD, Pittas AG. Vitamin D and type 2 diabetes: A systematic review. Eur J Clin Nutr. (2011) 65:1005–15. doi: 10.1038/ejcn.2011.118
101. Song Y, Wang L, Pittas AG, Liana C. Blood 25-hydroxy vitamin D levels and incident type 2 diabetes. A meta-analysis of prospective studies. Diabetes Care. (2013) 36:1422–8. doi: 10.2337/dc12-0962
102. Afzal S, Bojesen SE, Nordestgaard BG. Low 25-hydroxyvitamin D and risk of type 2 diabetes: a prospective cohort study and metaanalysis. Clin Chem. (2013) 59:381–91. doi: 10.1373/clinchem.2012.193003
103. Carrelli ABM, Horst, R, Cremers, S, Zhang, C, Bessler, M, Schrope, B, et al. Vitamin D storage in adipose tissue of obese and normal weight women. J Bone Miner Res. (2017) 32:237–42. doi: 10.1002/jbmr.2979
104. Bellou V, Belbasis L, Tzoulaki I, Evangelou E. Risk factors for type 2 diabetes mellitus: an exposure-wide umbrella review of meta-analyses. PLoS ONE. (2019) 13:e0194127. doi: 10.1371/journal.pone.0194127
105. Issa CM. Vitamin D and type 2 diabetes mellitus. Ultraviolet light in human health, diseases and environment. Ahmad, S, Springer. (2017) 996:193–205. doi: 10.1007/978-3-319-56017-5_16
106. Gasparri C, Perna S, Spadaccini D, Alalwan T, Girometta C, Infantino V, et al. Is vitamin D-fortified yogurt a value-added strategy for improving human health? A systematic review and meta-analysis of randomized trials. J Dairy Sci. (2019) 102:8587–603. doi: 10.3168/jds.2018-16046
107. Hu Z, Chen J, Sun X, Wang L, Wang A. Efficacy of vitamin D supplementation on glycemic control in type 2 diabetes patients: A meta-analysis of interventional studies. Medicine (Baltimore). (2019) 98:e14970. doi: 10.1097/MD.0000000000014970
108. George PS, Pearson ER, Witham MD.Effect of Vitamin D supplementation on glycaemic control and insulin resistance: a systematic review and meta-analysis. Diabet Med. (2012) 29:e142–150. doi: 10.1111/j.1464-5491.2012.03672.x
109. Bolland MJ, Grey A, Avenell A, Gamble GD, Reid IR. Calcium supplements with or without vitamin D and risk of cardiovascular events: reanalysis of theWomen’s Health Initiative limited access dataset and meta-analysis. BMJ. (2011) 342:d2040. doi: 10.1136/bmj.d2040
110. Mao PJ, Zhang C, Tang L, Xian YQ, Li YS, Wang WD, et al. Effect of calcium or vitamin D supplementation on vascular outcomes: a metaanalysis of randomized controlled trials. Int J Cardiol. (2013) 169:106–11. doi: 10.1016/j.ijcard.2013.08.055
111. Larsson SC, Burgess S, Michaelsson K. Association of genetic variants related to serum calcium levels with coronary artery disease and myocardial infarction. JAMA. (2017) 318:371–80. doi: 10.1001/jama.2017.8981
112. Reid IR, Bristow SM, Bolland MJ. Calcium supplements: benefits and risks. Intern Med. (2015) 278:354–68. doi: 10.1111/joim.12394
113. Reid IR, Bolland MJ. Calcium and/or Vitamin D supplementation for the prevention of fragility fractures: Who needs it?. Nutrients. (2020) 12:1011. doi: 10.3390/nu12041011
114. Kim KN, Oh SY, Hong YC. Associations of serum calcium levels and dietary calcium intake with incident type 2 diabetes over 10 Years: The Korean Genome and Epidemiology Study (KoGES). Diabetol Metab Syndr. (2018)10:50. doi: 10.1186/s13098-018-0349-y
115. Hill D, Sugrue I, Arendt E, Hill C, Stanton C, Rossa RP. Recent advances in microbial fermentation for dairy and health. F1000Res. (2017) 6:751. doi: 10.12688/f1000research.10896.1
116. Huth P, Park K. Influence of dairy product and milk fat consumption on cardiovascular disease risk: a review of the evidence. Adv Nutr. (2012) 3:266–85. doi: 10.3945/an.112.002030
117. Astrup A. Yogurt and dairy product consumption to prevent cardiometabolic diseases: epidemiologic and experimental studies. Am J Clin Nutr. (2014) 99:1235S−42S. doi: 10.3945/ajcn.113.073015
118. Hansen TH, Gøbel RJ, Hansen T. The gut microbiome in cardio-metabolic health. Genome Med. (2015) 7: 33. doi: 10.1186/s13073-015-0157-z
119. Yadav H, Lee JH, Lloyd J, Walter P, Rane SG. Beneficial metabolic effects of a probiotic via butyrate-induced GLP-1 hormone secretion. J Biol Chem. (2013) 288:25088–97. doi: 10.1074/jbc.M113.452516
120. Bron PA, Kleerebezem M, Brummer RJ, Cani PD, Mercenier A, MacDonald TT, et al. Can probiotics modulate human disease by impacting intestinal barrier function? Br J Nutr. (2017) 117:93–107. doi: 10.1017/S0007114516004037
121. Bordalo Tonucci LKM, Olbrich Dos Santos CL, De Luces Fortes, Ferreira, Rocha Ribeiro SM, et al. Gut microbiota and probiotics: focus on diabetes mellitus. Crit Rev Food Sci Nutr. (2017) 57:2296–309. doi: 10.1080/10408398.2014.934438
122. Barengolts E. Gut microbiota, prebiotics, probiotics, and synbiotics in management of obesity and prediabetes: review of randomised controlled trials. Endocr Pract. (2016) 22:1224–34. doi: 10.4158/EP151157.RA
123. Barengolts E, Daviau Smith E, Reutrakul S, Tonucci L, Anothaisintawee T. The effect of probiotic yogurt on glycemic control in type 2 diabetes or obesity: A meta-analysis of nine randomized controlled trials. Nutrients. (2019) 11:671. doi: 10.3390/nu11030671
124. Companys J, Pla-Pag,à L, Calderón-Pérez L, Llaurad,ó E, Sol,à R, Pedret A, et al. Fermented dairy products, probiotic supplementation, and cardiometabolic diseases: A systematic review and meta-analysis. Adv Nutr. (2020) 11:834–63. doi: 10.1093/advances/nmaa030
125. Michalski MC. On the supposed influence of milk homogenization on the risk of CVD, diabetes and allergy. Br J Nutr. (2007) 97:598–610. doi: 10.1017/S0007114507657900
126. Drouin-Chartier J, Côté J, Labonté M, Brassard D, Tessier-Grenier M, Desroches S, et al. Comprehensive review of the impact of dairy foods and dairy fat on cardiometabolic risk. Adv Nutr. (2016) 7:1041–51. doi: 10.3945/an.115.011619
127. Dietary-Guidelines-Advisory-Committee. Scientific report of the 2015 Dietary Guidelines Advisory Committee.Washington:DC: 1689–1699: USDA and US Department of Health and Human Services. (2015).
128. Hooper L,Martin N, Jimoh OF, Kirk C, Foster E, Abdelhamid AS. Reduction in saturated fat intake for cardiovascular disease. CochraneDatabase Syst Rev. (2020) 8. doi: 10.1002/14651858.CD011737.pub3
129. de Goede J, Geleijnse JM, Ding EL, Soedamah-Muthu SS. Effect of cheese consumption on blood lipids: A systematic review and meta-analysis of randomized controlled trials. Nutr Rev. (2015) 73:259–75. doi: 10.1093/nutrit/nuu060
130. Dehghan M, Mente A, Rangarajan S, Sheridan P, Mohan V, Iqbal R, et al. Association of dairy intake with cardiovascular disease and mortality in 21 countries from five continents (PURE): A prospective cohort study. Lancet. (2018) 392:2288–97. doi: 10.1016/S0140-6736(18)31812-9
131. Drouin-Chartier JP, Brassard D, Tessier-Grenier M, Côté JA, Labonté ME, Desroches S, et al. Systematic review of the association between dairy product consumption and risk of cardiovascular-related clinical outcomes. Adv Nutr. (2016) 7:1026–40. doi: 10.3945/an.115.011403
132. Pimpin L, Wu JH, Haskelberg H, DelGobbo L, Mozaffarian D. Is butter back? A systematic review and meta-analysis of butter consumption and risk of cardiovascular disease, diabetes, and total mortality. PLoS ONE. (2016) 11:e0158118. doi: 10.1371/journal.pone.0158118
133. Guo J, Astrup A, Lovegrove JA, Gijsbers L, Givens DI, Soedamah-Muthu SS. Milk and dairy consumption and risk of cardiovascular diseases and all-cause mortality: dose-response metaanalysis of prospective cohort studies. Eur J Epidemiol. (2017) 32:269–87. doi: 10.1007/s10654-017-0243-1
134. Wu L, Sun D. Consumption of yogurt and the incident risk of cardiovascular disease: A meta-analysis of nine cohort studies. Nutrients. (2017) 9:315. doi: 10.3390/nu9030315
135. Hirahatake KM, Astrup A, Hill JO, Slavin JL, Allison DB,Maki KC. Potential cardiometabolic health benefits of full-fat dairy: The evidence base. Adv Nutr. (2020) 11:533–47. doi: 10.1093/advances/nmz132
136. Kim J, Hoang T, Bu SY, Kim JM, Choi JH, Park E, et al. Associations of dietary intake with cardiovascular disease, blood pressure, and lipid profile in the Korean population: a systematic review and meta-analysis. J Lipid Atheroscler. (2020) 9:205–29. doi: 10.12997/jla.2020.9.1.205
137. Clifton P. Metabolic syndrome-role of dietary fat type and quantity. Nutrients. (2019) 11:1438. doi: 10.3390/nu11071438
138. Neuenschwander M, Ballon A, Weber KS, Norat T, Aune D, Schwingshackl L, et al. Role of diet in type 2 diabetes incidence: umbrella review of meta-analyses of prospective observational studies. BMJ. (2019) 366:l2368. doi: 10.1136/bmj.l2368
139. Schwingshackl L, Hoffmann G, Lampousi AM, Knüppel S, Iqbal K, Schwedhelm C, et al. Food groups and risk of type 2 diabetes mellitus: a systematic review and meta-analysis of prospective studies. Eur J Epidemiol. (2017) 32:363–75. doi: 10.1007/s10654-017-0246-y
140. Soedamah-Muthu SS, de Goede J. Dairy consumption and cardiometabolic diseases: systematic review and updated meta-analyses of prospective cohort studies. Curr Nutr Rep. (2018) 7:171–82. doi: 10.1007/s13668-018-0253-y
141. Margolis K, Wei F, de Boer I, Howard B, Liu S, Manson J, et al. A diet high in low-fat dairy products lowers diabetes risk in postmenopausal women. J Nutr. (2011) 141:1969–74. doi: 10.3945/jn.111.143339
142. Sluijs I, Forouhi N, Beulens JY, van der Schouw Agnoli C, Arriola L, Balkau B. The amount and type of dairy product intake and incident type 2 diabetes: results from the EPIC-InterAct Study. Am J Clin Nutr. (2012) 96:382–90. doi: 10.3945/ajcn.111.021907
143. Kirii K, Mizoue T, Iso H, Takahashi Y, Kato K, Inoue M, et al. Calcium, vitamin D and dairy intake in relation to type 2 diabetes risk in a Japanese cohort. Diabetologia. (2009) 52:2542–50. doi: 10.1007/s00125-009-1554-x
144. Fumeron F, Lamri A, Abi Khalil C, Jaziri R, Porchay-Balderelli I, Lantieri O, et al. Dairy consumption and the incidence of hyperglycemia and the metabolic syndrome: results from a french prospective study, Data from the Epidemiological Study on the Insulin Resistance Syndrome (DESIR). Diabetes Care. (2011) 34:813–7. doi: 10.2337/dc10-1772
145. Grantham N, Magliano D, Hodge A, Jowett J, Meikle P, Shaw J. The association between dairy food intake and the incidence of diabetes in Australia: the Australian Diabetes Obesity and Lifestyle Study (AusDiab). Public Health Nutr. (2013) 16:339–45. doi: 10.1017/S1368980012001310
146. Louie J, Flood V, Rangan A, Burlutsky G, Gill T, Gopinath B, et al. Higher regular fat dairy consumption is associated with lower incidence of metabolic syndrome but not type 2 diabetes. Nutr Metab Cardiovasc Dis. (2013)23:816–21. doi: 10.1016/j.numecd.2012.08.004
147. Soedamah-Muthu S, Masset G, Verberne L, Geleijnse J, Brunner E. Consumption of dairy products and associations with incident diabetes, CHD and mortality in the Whitehall II study. Br J Nutr. (2013) 109:718–26. doi: 10.1017/S0007114512001845
148. Struijk E, Heraclides A, Witte D, Soedamah-Muthu S, Geleijnse J, Toft U, et al. Dairy product intake in relation to glucose regulation indices and risk of type 2 diabetes. Nutr Metab Cardiovasc Dis. (2013) 23:822–8. doi: 10.1016/j.numecd.2012.05.011
149. Ericson U, Hellstrand S, Brunkwall L, C.-,Schulz A, Sonestedt E, Wallström P, et al. Food sources of fat may clarify the inconsistent role of dietary fat intake for incidence of type 2 diabetes. Am J Clin Nutr. (2015) 101:1065–80. doi: 10.3945/ajcn.114.103010
150. Poppitt S, Keogh G, Mulvey T, McArdle B, MacGibbon A, Cooper G. Lipidlowering effects of a modified butter-fat: a controlled intervention trial in healthy men. Eur J Clin Nutr. (2002) 56:64–71. doi: 10.1038/sj.ejcn.1601282
151. Poppitt S, Keogh G, Mulvey T, Phillips A, McArdle B, MacGibbon A, et al. Effect of moderate changes in dietary fatty acid profile on postprandial lipaemia, haemostatic and related CVD risk factors in healthy men. Eur J Clin Nutr. (2004) 58:819–27. doi: 10.1038/sj.ejcn.1601882
152. Turpeinen O, Karvonen M. J., Pekkarinen M, Miettinen M, Elosuo R, Paavilainen E. Dietary prevention of coronary heart disease: the Finnish mental hospital study. Int J Epidemiol. (1979)
8:99–118. doi: 10.1093/ije/8.2.99
153. Miettinen M, Turpeinen O, Karvonen MJ, Pekkarinen M, Paavilainen E, Elosuo R. Dietary prevention of coronary heart disease in women: the Finnish mental hospital study. Int J Epidemiol. (1983) 12:17–25. doi: 10.1093/ije/12.1.17
154. Lichtenstein A. Dietary fat and cardiovascular disease: ebb and flow over the last half century. Adv Nutr. (2019) 10:S332–9. doi: 10.1093/advances/nmz024
155. Rideout TC, Marinangeli CP, Martin H, Browne RW, Rempel CB. Consumption of low-fat dairy foods for 6 months improves insulin resistance without adversely affecting lipids or bodyweight in healthy adults: a randomized free-living cross-over study. Nutr J. (2013) 12:56. doi: 10.1186/1475-2891-12-56
156. Crichton GE, Howe PRC, Buckley JD, Coates AM, Murphy KJ. Dairy consumption and cardiometabolic health: outcomes of a 12-month crossover trial. Nutr Metab. (2012) 9:19 doi: 10.1186/1743-7075-9-19
157. O’Connor S, Julien P, Weisnagel SJ, Gagnon C, Rudkowska I. Impact of a high intake of dairy product on insulin sensitivity in hyperinsulinemic adults: A crossover randomized controlled trial. Curr Dev Nutr. (2019) 24:nzz083. doi: 10.1093/cdn/nzz083
158. Turner KM, Keogh JB, Clifton PM. Dairy consumption and insulin sensitivity: a systematic review of short- and longterm intervention studies. Nutr Metab Cardiovasc Dis. (2015) 25:3–8. doi: 10.1016/j.numecd.2014.07.013
159. O’Connor S, Turcotte A. F., Gagnon C, Rudkowska, I. Increased dairy product intake modifies plasma glucose concentrations and glycated hemoglobin: A systematic review and meta-analysis of randomized controlled trials. Adv Nutr. (2019) 10:262–79. doi: 10.1093/advances/nmy074
160. Sochol KM, Johns TS, Buttar RS, Randhawa L, Sanchez E, Gal M, et al. The effects of dairy intake on insulin resistance: a systematic review and meta-analysis of randomized clinical trials. Nutrients. (2019) 17:2237. doi: 10.3390/nu11092237
161. Hansson P, Holven K, Øyri L, Brekke H, Biong A, Gjevestad G, et al. Meals with similar fat content from different dairy products induce different postprandial triglyceride responses in healthy adults: A randomized controlled cross-over trial. J Nutr. (2019) 149:422–31. doi: 10.1093/jn/nxy291
162. Nestel P, Chronopulos A, CehunM.Dairy fat in cheese raises LDL cholesterol less than that in butter in mildly hypercholesterolaemic subjects. Eur J Clin Nutr. (2005) 59:1059–63. doi: 10.1038/sj.ejcn.1602211
163. Hjerpsted J, Leedo E, Tholstrup T. Cheese intake in large amounts lowers LDL-cholesterol concentrations compared with butter intake of equal fat content. Am J Clin Nutr. (2011) 94:1479–84. doi: 10.3945/ajcn.111.022426
164. Dekker L, Vinke P, Riphagen I,Minovi´c I, EggersdorferME, van den Heuvel, Schurgers L, et al. Cheese and healthy diet: associations with incident cardiometabolic diseases and all-cause mortality in the general population. Front Nutr. (2019) 6:185. doi: 10.3389/fnut.2019.00185
165. Soerensen KV, Thorning TK, Astrup A, Kristensen M, Lorenzen JK. Effect of dairy calcium from cheese and milk on fecal fat excretion, blood lipids, and appetite in young men. Am J Clin Nutr. (2014) 99:984–91. doi: 10.3945/ajcn.113.077735
166. Poppitt SD, Prentice AM. Energy density and its role in the control of food intake: evidence from metabolic and community studies. Appetite. (1996) 26:153–74. doi: 10.1006/appe.1996.0013
167. Hossein Rouhani M, Haghighatdoost F, Surkan PJ, Azadbakht L. Associations between dietary energy density and obesity: a systematic review and meta-analysis of observational studies. Nutrition. (2016) 32:1037–47. doi: 10.1016/j.nut.2016.03.017
168. Alonso A, Zozaya C, Vázquez Z, Martínez JA, Martínez-González MA. The effect of low-fat versus whole-fat dairy product intake on blood pressure and weight in young normotensive adults. J Hum Nutr Diet. (2009) 22:336–42. doi: 10.1111/j.1365-277X.2009.00967.x
169. de Oliveira Otto M, Anderson C, Dearborn J, Ferranti E, Mozaffarian D, Rao G, et al. Dietary diversity: implications for obesity prevention in adult populations: a science advisory from the American Heart Association. Circulation. (2018) 138:e160–168. doi: 10.1161/CIR.0000000000
000595
170. Eckel RH, Jakicic JM, Ard J, deJesus DJM, Miller NH, Hubbard VS, et al. 2013 AHA/ACC guideline on lifestyle management to reduce cardiovascular risk: A report of the American College of Cardiology/American Heart Association task force on practice guidelines. Circulation. (2013) 129:S76–99. doi: 10.1161/01.cir.0000437740.48606.d1
171. American-Diabetes-Association. Lifestyle management: Standards of medical care in diabetes. Diabetes Care. (2019) 42:S46–60. doi: 10.2337/dc19-S005
172. Piepoli MF, Hoes AW, Agewall S, Albus C, Brotons C, Catapano AL, et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J. (2016) 37:2315–81. doi: 10.1093/eurheartj/ehw106
173. Mann JI, De Leeuw I, Hermansen K, Karamanos B, Karlstrom B, Katsilambros N, et al. Evidence-based nutritional approaches to the treatment and prevention of diabetes mellitus. Nutr Metab Cardiovasc Dis. (2004) 14:373–94. doi: 10.1016/S0939-4753(04)80028-0
174. Davies MJ, D’Alessio DA, Fradkin J, Kernan WN, Mathieu C, Mingrone G, et al. Management of hyperglycemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. (2018) 41:2669–701. doi: 10.2337/dci18-0033
175. Davies MJ, D’Alessio DA, Fradkin J, Kernan WN, Mathieu C, Mingrone G, et al. Management of Hyperglycemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia. (2018) 61:2461–98. doi: 10.1007/s00125-018-4729-5
176. van Horn L, Carson JS, Appel LJ, Burke LE, Economos C, Karmally W, et al. Recommended dietary pattern to achieve adherence to the American Heart Association/American College of Cardiology (AHA/ACC) guidelines: A scientific statement from the American Heart Association. Circulation. (2016) 134:e505–29. doi: 10.1161/CIR.0000000000000462
177. Uusitupa M, Schwab U. Evolving nutritional therapy for diabetes mellitus. Nutrients. (2020) 12:423. doi: 10.3390/nu12020423































































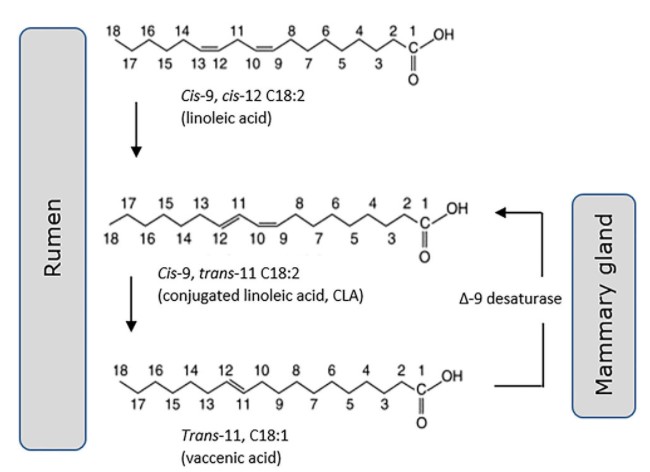




Scrivi un commento
Devi accedere, per commentare.